
题目列表(包括答案和解析)
6.下列说法中正确的是
A. p轨道之间以“肩并肩”重叠可形成σ键
B. p轨道之间以“头对头”重叠可形成π键
C. s和p轨道以“头对头”重叠可形成σ键
D. 共价键是两个原子轨道以“头对头”重叠形成的
5. 下列物质中,难溶于CCl4的是
A.碘单质 B. 水 C. 苯 D.甲烷
4. 下列关于官能团的判断中说法错误的是
A.醇的官能团是羟基(-OH) B.羧酸的官能团是羟基(-OH)
C.酚的官能团是羟基(-OH) D.烯烃的官能团是双键
3. 关于CO2说法正确的是
A. 碳原子采取sp杂化 B. CO2是正四面体型结构 C. 干冰是原子晶体 D. CO2为极性分子
2. 下列晶体熔化时不需要破坏化学键的是
A. 晶体硅 B .食盐 C .干冰 D .金属钾
1. 以下能级符号不正确的是
A.3s B.3p C .3d D.3f
21. (11分) 已知:R-CH=CH-O-R′  R-CH2CHO + R′OH
R-CH2CHO + R′OH
(烃基烯基醚)
Ⅰ. 烃基烯基醚A的相对分子质量(Mr)为176,分子中碳氢原子数目比为3∶4 。与A相关的反应如下:
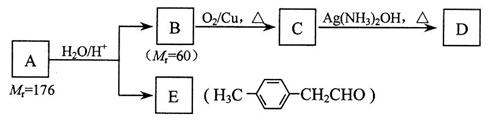
请回答下列问题:
⑴ A的分子式为_________________。
⑵ B分子中没有支链,B的名称是___________________;A的结构简式为________________________。
⑶ 写出C → D反应的化学方程式:_______________________________________。
⑷ 写出两种同时符合下列条件的E的同分异构体的结构简式:K^S*5U.C#O
_________________________、________________________。
① 属于芳香醛;
② 苯环上有两种不同环境的氢原子。
Ⅱ.由E转化为对甲基苯乙炔(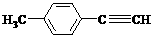 )的一条路线如下:
)的一条路线如下:
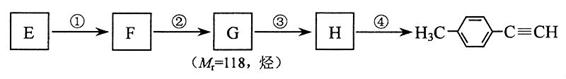
⑸ 写出G的结构简式:____________________________________。K^S*5U.C#O
⑹ 写出① ~ ④步反应所加试剂及反应条件:
|
序号 |
所加试剂及反应条件 |
|
① |
|
|
② |
|
|
③ |
|
|
④ |
|
20.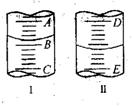 (11分)
(11分)
(1)图I表示10mL量筒中液面的位置,A与B,B与C刻度间相差1mL,如果刻度A为4,量筒中液体的体积是____________mL。图II表示50mL滴定管中液面的位置,如果液面处的读数是a,则滴定管中液体的体积(填代号)______________。
A.是a mL B.是(50-a)mL C.一定大于a mL D.一定大于(50-a)mL
(2)某学生用0.1000mol/L KOH溶液测定未知浓度的盐酸溶液,其操作可分为如下几步:
(A)用待测盐酸溶液润洗酸式滴定管2-3次
(B)取待测盐酸溶液注入酸式滴定管至0刻度以下,把盛有待测溶液的酸式滴定管固定好,记下读数0.12mL
(C)移取20.00mL标准KOH溶液注入用蒸馏水洗净但未干燥的锥形瓶,并加入2-3滴酚酞
(D)把锥形瓶放在酸式滴定管的下面,并在瓶子底下垫一块白瓷砖(或白纸),小心滴入酸液,边滴边旋摇锥形瓶,眼睛注视液面变化。
(F)至终点时关闭活塞,半分钟后不恢复原色,记下滴定管液面的刻度20.2mL
完成以下填空:
①指出上述实验过程中的错误之处(用编号表示,并写出正确操作方法)
②判断到达终点的现象是溶液由____________色变为_____________色。
③在其他操作皆正确的前提下出现以下情况,会给测定结果带来怎样的影响?(填偏高、偏低、无影响)
a.若滴定前仰视酸式滴定管中液面,滴定后俯视液面,测定结果
b. 滴定过程中,振荡锥形瓶时,不小心将锥形瓶中溶液溅出两滴
19.(6分)
今有①CH3COOH;②HCl;③H2SO4三种溶液,请用代号填空(如:①>②>③ )
(1)当它们pH相同时,其物质的量浓度关系是 。
(2)当它们的物质的量浓度相同时,其pH的关系是 。
(3)中和等体积、等物质的量浓度的烧碱溶液,需同物质的量浓度的三种酸溶液的体积关系为 。
(4)体积和物质的量浓度相同的①、②、③三溶液,分别与同浓度的烧碱溶液反应,要使反应后的溶液呈中性,所需烧碱溶液的体积关系为 。
(5)当它们pH相同、体积相同时,分别加入足量锌,相同状况下产生气体体积关系为 。
(6)将pH相同的三种酸均稀释10倍后,pH关系为 。
18.(16分)
二甲醚是一种重要的清洁燃料,也可替代氟利昂作制冷剂等,对臭氧层无破坏作用。工业上可利用煤的气化产物(水煤气)合成二甲醚。
请回答下列问题:
⑴ 煤的气化的主要化学反应方程式为:_____________________________________。
⑵ 煤的气化过程中产生的有害气体H2S用Na2CO3溶液吸收,生成两种酸式盐,该反应的化学方程式为:_________________________________________________________。
⑶ 利用水煤气合成二甲醚,同时生成CO2,三步反应如下:
① 2H2(g)+ CO(g) CH3OH(g) ΔH = -90.8
kJ·mol-1
CH3OH(g) ΔH = -90.8
kJ·mol-1
② 2CH3OH(g) CH3OCH3(g)+ H2O(g) ΔH= -23.5 kJ·mol-1
CH3OCH3(g)+ H2O(g) ΔH= -23.5 kJ·mol-1
③ CO(g)+ H2O(g) CO2(g)+ H2(g) ΔH=
-41.3 kJ·mol-1
CO2(g)+ H2(g) ΔH=
-41.3 kJ·mol-1
写出用水煤气合成二甲醚的热化学方程式
一定条件下的密闭容器中,该总反应达到平衡,要提高CO的转化率,可以采取的措施是__________(填字母代号)。
a.高温高压 b.加入催化剂 c.减少CO2的浓度
d.增加CO的浓度 e.分离出二甲醚
⑷ 已知反应② 2CH3OH(g) CH3OCH3(g)+ H2O(g)某温度下的平衡常数为400 。此温度下,在密闭容器中加入CH3OH ,反应到某时刻测得各组分的浓度如下:
CH3OCH3(g)+ H2O(g)某温度下的平衡常数为400 。此温度下,在密闭容器中加入CH3OH ,反应到某时刻测得各组分的浓度如下:
|
物质 |
CH3OH |
CH3OCH3 |
H2O |
|
浓度/(mol·L-1) |
0.44 |
0.6 |
0.6 |
① 比较此时正、逆反应速率的大小:v正 ______ v逆 (填“>”、“<”或“=”)。
② 若加入CH3OH后,经10 min反应达到平衡,此时c(CH3OH) = _________;该时间内反应速率v(CH3OH) = __________,CH3OH的转化率为 。
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com