
题目列表(包括答案和解析)
4.下列各元素,最易形成离子化合物的是( )
①第三周期第一电离能最小的元素 ②外围电子构型为2s22p6的原子
③2p能级为半满的元素 ④电负性最大的元素
A.①② B.③④ C.②③ D.①④
3.按照第一电离能由大到小的顺序排列错误的是 ( )
A Be、Mg、Ca B. Be、B、C、N
C. He、Ne、Ar D. Li、Na、K
2.下列说法中正确的是 ( )
A.处于最低能量的原子叫做基态原子
B.3p2表示3p能级有两个轨道
C.同一原子中,1s、2s、3s电子的能量逐渐减小 www.k@s@5@ 高#考#资#源#网
D.同一原子中,2p、3p、4p能级的轨道数依次增多
1.下列离子中,半径最大的是( )
A.O2- B.S2- C.Mg2+ D.Cl-
27.氢氧化钙在 时,每
时,每 水仅溶解
水仅溶解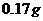 。
。
(1)求在 将
将 水中加入
水中加入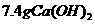 固体,求溶液中的
固体,求溶液中的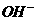 的物质的量
的物质的量
浓度(密度为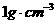 )
)
(2)在上述的混合物液体中需加入几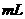
 的
的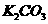 溶液,才能使
溶液,才能使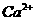
的浓度降至 ?ks5*u
?ks5*u
(3)已知 时
时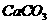 在水里达到溶液平衡(
在水里达到溶液平衡(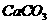

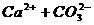 )时,
)时,
其离子浓度之积为一常数,即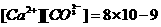 。在
。在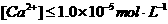 时可以视为
时可以视为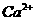 沉淀完全。在前述(1)溶液中要使
沉淀完全。在前述(1)溶液中要使
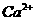 沉淀完全,求应加入
沉淀完全,求应加入
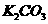 溶液的最小体积。
溶液的最小体积。
 南马高中2011年上学期期中考试试卷
南马高中2011年上学期期中考试试卷
26.为了度量水中有机物等还原性污染物的含量,通常把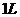 水样与强氧化剂完全作用时
水样与强氧化剂完全作用时
消耗氧化剂的量,折算成以氧气为氧化剂时的质量(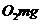
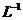 )来表示,称为该水
)来表示,称为该水
样的化学耗氧量( )。我国明文规定:
)。我国明文规定: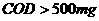
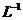 )的污水不得直接排
)的污水不得直接排
放。
为测定某工业为水的 ,实验如下:量取废水样品
,实验如下:量取废水样品 ,加入
,加入

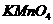 溶液
溶液 和少量稀
和少量稀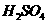 ,在一定条件下充分反应后,再
,在一定条件下充分反应后,再
用 的草酸钠(
的草酸钠(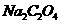 )溶液滴定过量的
)溶液滴定过量的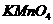 ,达到终点时消耗
,达到终点时消耗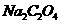 溶液
溶液 。ks5*u
。ks5*u
(1)写出在酸性介质中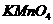 (被还原为
(被还原为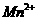 )与
)与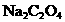 (被氧化为
(被氧化为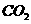 )
)
反应的离子方程式 。ks5*u
(2)计算该水样的 ,写出计算过程。
,写出计算过程。
25.对于弱酸,在一定温度下达到电离平衡时,各微粒的浓度存在一种定量的关系。
若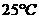 时有
时有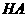

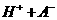 ,则
,则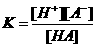 式中:
式中: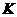 为电离平衡常数,只与
为电离平衡常数,只与
温度有关,[ ]为各微粒的平衡浓度。下表是几种常见弱酸的电离平衡常数(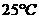 )
)
|
酸 |
电离方程式 |
电离平衡常数K |
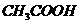 |
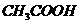  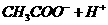 |
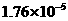 |
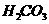 |
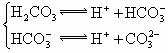 |
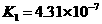 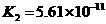 |
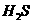 |
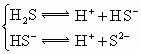 |
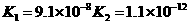 |
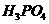 |
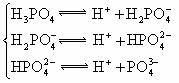 |
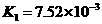 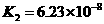 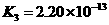 |
回答下列各问:
(1)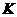 只与温度有关,当温度升高时,
只与温度有关,当温度升高时,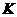 值
(填“增大”、“减小”、
值
(填“增大”、“减小”、
“不变”)。 ks5*u
(2)在温度相同时,各弱酸的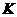 值不同,那么K值的大小与酸性的相对强弱有何关系?
值不同,那么K值的大小与酸性的相对强弱有何关系?
(3)若把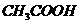 、
、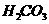 、
、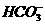 、
、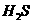 、
、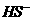 、
、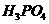 、
、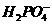 、
、
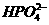 都看作是酸,其中酸性最强的是
,最弱的是 。
都看作是酸,其中酸性最强的是
,最弱的是 。
(4)多元弱酸是分步电离的,每一步都有相应的电离平衡常数。对于同一种多元弱酸
的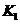 、
、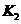 、
、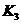 之间存在着数量上的规律,此规律是 ,产生此规律的原因
之间存在着数量上的规律,此规律是 ,产生此规律的原因
是 。
(5)电离平衡常数是用实验的方法测定出来的,现已经测得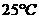 时,
时,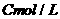 的
的
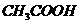 的电离数为 。试表示该温度下醋酸的电离平衡常数
的电离数为 。试表示该温度下醋酸的电离平衡常数
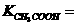 。
。
24.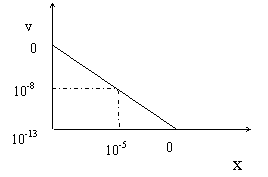 某温度
某温度 下的溶液中,
下的溶液中,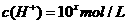 ,
,
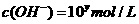 。
。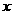 与
与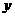 的关系如右图所
的关系如右图所
示:此温度时,水的离子积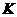 为 ,
为 ,
则该温度(填“大于”、“小于”或“等于”)
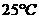 。若将此温度
。若将此温度 下
下
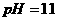 的苛性钠溶液
的苛性钠溶液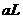 与
与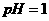 的稀硫酸
的稀硫酸
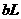 混合(假设混合后溶液体积的微小变化忽略
混合(假设混合后溶液体积的微小变化忽略
不计),试通过计算填写以下不同情况时两种溶
液的体积比:(要求有计算过程)
(1)若所得混合液为中性,则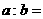 ;此溶液中各种离子的浓度由大到小
;此溶液中各种离子的浓度由大到小
排列顺序是 。
(2)若所得混合液的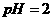 ,则
,则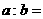 ;此溶液中各种离子的浓度由大到小
;此溶液中各种离子的浓度由大到小
排列顺序是 。
23.有甲、乙两份等体积的浓度均为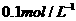 的氨水,
的氨水,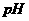 为
为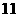 。
。
(1)甲用蒸馏水稀释 倍,则
倍,则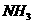
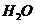 的电离平衡将向 (填
的电离平衡将向 (填
“促进”或“抑制”)电离的方向移动,溶液的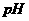 将为
(填序号)。
将为
(填序号)。
A.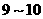 之间 B.
之间 B.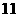 C.
C.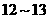 之间 D.
之间 D.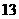
(2)乙用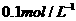 的氯化铵溶液稀释
的氯化铵溶液稀释 倍,稀释后的乙溶液与稀释后的甲溶液相
倍,稀释后的乙溶液与稀释后的甲溶液相
比较,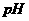 (填“甲大”、“乙大”、“相等”),其原因是 。
(填“甲大”、“乙大”、“相等”),其原因是 。
22.两种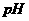 不同的
不同的 溶液,其
溶液,其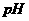 分别为
分别为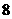 和
和 ,将这两种溶液等体积混合后溶
,将这两种溶液等体积混合后溶
液的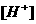 最接近于
最接近于
A.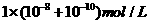 B.
B.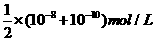
C.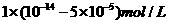 D.
D.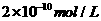
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com