
12.为实现2008北京“科技奥运”战略,我国兴奋剂检测生物芯片装置已定型和批量生产,可快捷检测常见的16种兴奋剂。已知某兴奋剂乙基雌烯醇(etylestrenol)的结构如下图所示。下列叙述中正确的是( )
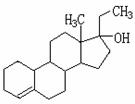
A.该物质可以视为酚类
B.该物质分子中的所有碳原子均共面
C.能使溴的四氯化碳溶液褪色
D.在浓硫酸作用下,分子内消去一个水分子,产物有两种同分异构体
11.厦门大学郑兰荪院士合成了C50Cl10富勒烯足球状分子如下图,50个碳原子组成若干个正六边形和正五边形,碳均为四价。有关C50Cl10的说法不正确的是( )
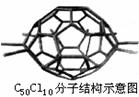
A.C50Cl10与C60互为同素异形体
B.C50Cl10分子中共用电子对数目为105个
C.C50Cl10相对分子质量为955
D.C50Cl10分子中含有55个碳碳单键
10.下列离子方程式中正确的是( )
A.NH4HSO4溶液中加入少量NaOH溶液:NH4++OH-=NH3·H2O
B.饱和石灰水与醋酸溶液混合:Ca(OH)2+2CH3COOH=Ca2++2CH3COO-+2H2O
C.氢氧化镁溶于稀硫酸:Mg(OH)2+2H+=Mg2++2H2O
D.氯气通入Na2SO3溶液中:Cl2+SO32-+H2O=SO42-+2HCl
9.元素X和Y在元素周期表中处于相邻周期,两种元素原子的质子数之和为21,Y元素原子的核外电子数比X元素原子的核外电子数多5。则下列叙述不正确的是( )
A.X和Y两元素形成的化合物在熔融状态下电解可以得到两元素的单质
B.Y元素的单质不能和金属氧化物反应
C.X和Y能构成一种阴离子,这种阴离子与过量H+反应可以转变为Y元素的阳离子
D.X元素的一种单质能有效地吸收太阳光线中的紫外线
8.设NA为阿伏加德罗常数的值,下列叙述中正确的是( )
A.92gNO2和N2O4混合气体中含有的原子数为6NA
B.标准状况下,11.2LSO3中含有的电子数为20NA
C.1mol苯分子中含有的碳碳双键数为3NA
D.1molMg与足量的O2或N2反应生成MgO或Mg3N2时,失去的电子数均为2NA
7.某无色透明的溶液中,放入铝片,立即有大量H2放出,则下列离子在溶液中可以大量存在的是( )
A.Ca2+、HSO3-、Cl-、Na+ B.H+、Mg2+、NO3-、Ba2+
C.S2-、SO32-、K+、SO42- D.Na+、K+、ClO-、SO32-
6.在一定的条件下,当64 g SO2气体被氧化成SO3气体时,共放出热量98.3 kJ。已知SO2在此条件下转化率为80%,据此,下列热化学方程式正确的是( )
A.SO2(g)+ 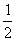 O2(g)
O2(g) 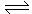 SO3(g);∆H=-78.64kJ/mol
SO3(g);∆H=-78.64kJ/mol
B.2SO2(g)+O2(g)
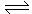 2SO3(g);∆H=-196.6kJ/mol
2SO3(g);∆H=-196.6kJ/mol
C.SO2(g)+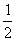 O2(g)
O2(g) 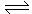 SO3(l);∆H=-98.3kJ/mol
SO3(l);∆H=-98.3kJ/mol
D.2SO2(g)+O2(g)
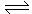 2SO3(g);∆H=+196.6kJ/mol
2SO3(g);∆H=+196.6kJ/mol
5.分类方法在化学学科的发展中起到了非常重要的作用。下列分类标准合理的是( )
① 根据酸分子中含有的H原子个数将酸分为一元酸、二元酸等
② 根据反应中是否有电子的转移将化学反应分为氧化还原反应和非氧化还原反应
③ 根据分散系是否具有丁达尔现象将分散系分为溶液、胶体和浊液
④ 根据反应中的热效应将化学反应分为放热反应和吸热反应
A.①③ B.②④ C.①②④ D.②③④
4.下列叙述中的四种非金属元素,所形成的气态氢化物的稳定性最差的是( )
A.构成矿物和岩石的主要元素 B.空气中质量分数最高的元素
C.单质在常温下呈液态的元素 D.形成化合物种类最多的元素
3.不具有放射性的同位素称之为稳定同位素,稳定同位素分析法在近20年来植物生理学、生态学和环境科学研究中获得广泛应用。如在陆地生态系统研究中,2H、13C、15N、18O、34S等常用作环境分析指示物。下列有关说法正确的是( )
A.34S原子核内中子数为16
B.1H216O和1H218O的相对分子质量不同
C.13C和15N原子核内的质子数相差2
D.2H+的结合OH-的能力比1H+的更强
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com