
22.(8分)现有只含C、H、O的化合物A-D,下图方框内给m了它们的有关信息。
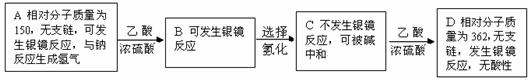
(1)试写出D的分子式
(2)试写出A发生银镜反应的化学方程式 。
21.(10分)《2007年江苏省环境状况公报》指出:江苏省2007年工业(主要是热电厂)二氧化硫排放总量为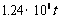 ,全省酸雨污染比较严重。分析降雨成分发现,雨水中阴离子仍以硫酸根离子为主,约占阴离子总量的61.9%,阳离子以铵根离子为主。约占阳离子总量的84.1%.阴离子中
,全省酸雨污染比较严重。分析降雨成分发现,雨水中阴离子仍以硫酸根离子为主,约占阴离子总量的61.9%,阳离子以铵根离子为主。约占阳离子总量的84.1%.阴离子中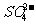 和
和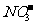 的质量比为4.13:l,
的质量比为4.13:l,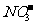 的比例呈明显上升的趋势。回答下列问题:
的比例呈明显上升的趋势。回答下列问题:
(1)江苏省大气污染特征是 。
A.煤烟型
B.机动车尾气型
C.由煤烟型向煤烟型与机动车尾气混合型转化
D.由机动车尾气型向煤烟型与机动车尾气混合型转化
(2)提出江苏省防治酸雨的两条主要措施:
(3)某校研究性学习小组拟选择“不同地点空气中二氧化硫的含量分析”的课题进行探究。
①请参加该课题的探究,在小组讨论测定地点时,建议选择的测定地点分别是
②通过查阅资料后发现,1994年以前,人们常采用HgCl2、NaCl的混合溶液吸收二氧化硫,1994年国家颁布标准(GB/Tl5262-94)规定用甲醛溶液吸收二氧化硫。变更吸收剂的原因除了用甲醛溶液的吸收效果比较好外,另一个原因可能是 。
③甲醛溶液吸收二氧化硫以后发生了如下反应,生成稳定的羟基甲磺酸。
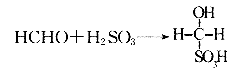 该反应类型属于 。测定时,只需向吸收空气的甲醛吸收液中加入适量NaOH和指示剂,SO2与指示剂、甲醛反应生成可溶性紫红色化合物,根据溶液颜色深浅(用吸光度A表示,可由仪器进行测量),就能确
该反应类型属于 。测定时,只需向吸收空气的甲醛吸收液中加入适量NaOH和指示剂,SO2与指示剂、甲醛反应生成可溶性紫红色化合物,根据溶液颜色深浅(用吸光度A表示,可由仪器进行测量),就能确
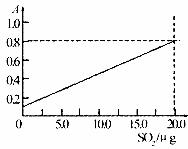
定二氧化硫的含量。实验测得SO2含量与溶液的吸光度A的关系如下图所示。若欲测定某地空气中二氧化硫的含量(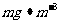 ),除需要测定吸光度A外还需要记录的数据为 。
),除需要测定吸光度A外还需要记录的数据为 。
20.(10分)已知:A为常见金属,B是一种盐,C中A元素的质量分数为25.3%,K是一种重要的矿石,D、E、G、H常温下均为气体,L是红褐色固体。②、③、⑤均为工业生产中的重要反应。各物质问的相互转化关系如下图(其中某些反应的部分生成物被略去)
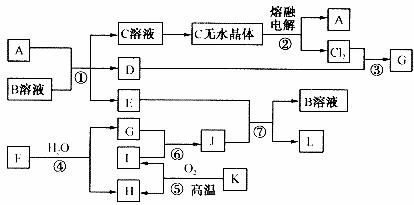
请按要求填空:
(1)工业生产中,实现反应⑤的设备是 。
(2)由“C溶液→C的无水晶体”需特定的气体氛围,该气体是上述转化关系中的 (填“字母”)。
(3)反应①的离子方程式为 :
将J滴入沸水中的离子方程式为
(4)若反应④表示为“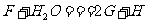 ”,则可推知F的化学式为
”,则可推知F的化学式为
19.(8分)X、Y、Z、W是原子序数依次增大的短周期元素,且互不同族;其中只有两种为金属;X原子的最外层电子数与次外层电子数相等;X与W、Y与Z这两对原子的最外层电子数之和均为9。单质Y和w都可与浓的NaOH溶液反应。请回答下列问题:
(1)Y、Z、W的原子半径由小到大的顺序是 。
(2)ZW2的电子式是 ,它在常温下呈液态,形成晶体时,属于 晶体。
(3)工业生产单质Y的原理是 (用化学方程式表示)。
(4)X与Y化学性质相似,则X与浓的NaOH溶液反应的化学方程式是
(5)0.1 mol的单质W与50 mL1.5 mol/L,的FeBr2溶液反应,则被氧化的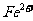 和
和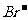 的物质的量之比是 。
的物质的量之比是 。
18.(12分)硝酸是一种重要的化工原料,工业上通常采用氨氧化法制取。某校化学兴趣小组的同学以氯化铵和氢氧化钙为主要原料并设计了如下图所示的装置来制硝酸(三氧化二铬为催化剂,加热及夹持装置未画出)。
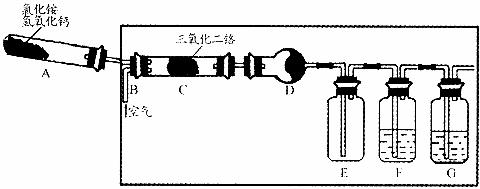
回答下列问题:
(1)实验时,A、C两装置均需加热,应先加热 装置.原因是
(2)D装置中应填充的物质是 .该物质的主要作用是
(3)E装置的作用是 F、G装置中的物质分别是 ,
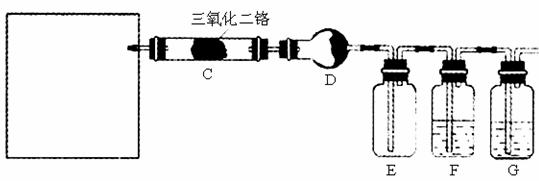
(4)若保留上图中黑色粗线框内的装置但去掉通空气的导管B,将C装置中的双孔橡皮塞换成单孔橡皮塞。请用图示的方法设计一个最简单的实验方案同样完成硝酸的制取(在图中的方框中划出装置图并注明所用药品的名称)。
17.(10分)
(1)某同学在实验室进行了下列实验操作,其中有错误的是(填写字母代号。多选倒扣分) 。
A.用食指顶住容量瓶瓶塞,用另一只手的手指托住瓶底把容量瓶倒转和摇动以使溶液混合均匀
B.用已用蒸馏水润湿的pH试纸测定盐酸的pH
C.用玻璃棒把固体物质从蒸发皿中转移到滤纸上
D.用乙醇制备乙烯时,将温度计的水银球放在反应混合液中
E.在石油进行蒸馏时。将温度计的水银球插在石油中
F.用碱式滴定管量取溶液时,用手指捏住玻璃球放液
(2)指出使用下列仪器或用品的第一步操作:
①托盘天平:
②酸式滴定管:
③红色石蕊试纸: 。
16.在一个固定体积为1L的密闭容器中,加入2molA和l molB发生如下反应:
2A(g)+B(g) 3C(g)+D(s).达到平衡时C的浓度为
3C(g)+D(s).达到平衡时C的浓度为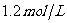 。若维持容器体积和温度不变,按下列方法改变起始物质.达到平衡时C的浓度仍为
。若维持容器体积和温度不变,按下列方法改变起始物质.达到平衡时C的浓度仍为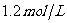 的是
的是
A.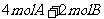
B.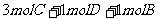
C.
D.
15.近年来,有人主张将长式周期表中的主,副族序号取消,改为由左向右排成18列.如I A族为第一列。按此,下面说法错误的是
A.这张周期表中存在1-l8号元素问应存在36个空格
B.原子序数≤56的属奇数的元素都位于奇数列
C.第十三列中包含5种元素
D.黑色金属位于第9-l0列中
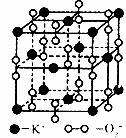
14.高温下,超氧化钾晶体呈立方体结构,晶体中氧的化合价可看作部分为0价,部分为一2价,下图为超氧化钾晶体的一个晶胞(晶体中最小的重复单元),则下列说法正确的是
A.晶体中与每个K+距离最近的K+有l2个
B.晶体中每个K+周围有8个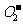 ,每个
,每个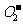 周围有8个K+
周围有8个K+
C.超氧化钾的化学式为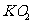 每个晶胞含有14个K+和13个
每个晶胞含有14个K+和13个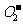
D.晶体中,0价氧原子与一2价氧原子的数目比可看作3:1
13.某有机物A是农药生产中的一种中间体,其结构为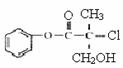 ,下列关于A的叙述正确的是
,下列关于A的叙述正确的是
A.属于芳香烃
B.易溶于水
C.1mol A可以与3mol NaOH反应
D.一定条件下可发生加成反应和消去反应
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com