
6.氢气是未来的绿色能源,科学家们最新研制出利用太阳能产生激光,再利用激光使水分解得到氢气的新技术,其中水分解可以用化学方程式表示为:2H2O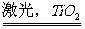 2H2 ↑ + O2 ↑ 。下列有关说法中不正确的是:
2H2 ↑ + O2 ↑ 。下列有关说法中不正确的是:
A.TiO2在反应中作氧化剂 B.水分解反应不能自发进行
C.该技术将太阳能转化为化学能 D.TiO2在反应中作催化剂
29.(13分)A-P是中学化学常见的单质及化合物。其中A、B、F每个分子中电子数目相同,F为生活中常见的无色无味液体;D、E、G为非金属单质,L为金属单质,C是一种还原性气体。各物质之间存在下列转化关系(个别产物略去)。
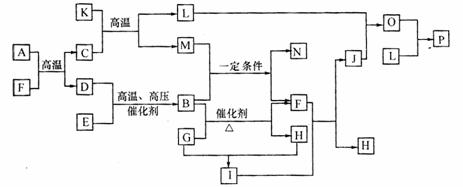
回答下列问题:
(1)K可能的化学式为
(2)N是一种常见的化学肥料,1个N分子中电子总数为32。则N的结构式为 .
(3)用C、G、KOH构成的燃料电池电解J的稀溶液,则原电池负极发生的反应为 ,
电解池阳极发生的反应为 。
(4)向O的稀溶液中加入少量氢碘酸,其反应的离子方程式为:
(5)若a g单质L完全溶解在稀的J溶液中,收集到标准状况下气体bL。则参加反应的J的物质的量取值范围为(用a或a、b的关系式表示) 。
28.(16分)某化学实验小组拟用以下装置由乙醇与浓硫酸共热制备乙烯,且进行乙烯的催化氧化实验。
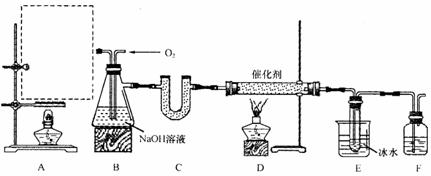
(1)在A处虚线框内绘出该实验装置图。
(2)装置B中盛有NaOH溶液,其作用是
① ,
② ;
③ 。
(3)若E中收集到的物质可发生银镜反应,则D中发生反应的化学方程式为(有机物写结构简式): 。
(4)用乙醇、浓硫酸共热制乙烯,所得乙烯产率较低,原因可能是 (填字母序号)。
A.乙醇部分挥发 B.乙醇部分生成乙醚
C.乙醇被氧化为C、CO、CO2 D.乙醇与浓硫酸生成无机酸酯
E.乙醇消去成乙炔
(5)实验完毕,待冷却后,通过以下步骤检验B装置中的阴离子:
Ⅰ.取少量溶液,滴入几滴酚酞,发现溶液变红,说明溶液中存在 (填离子符号);
Ⅱ.另取适量溶液,加入足量HCl,将产生的气体先通过品红溶液,若观察到 的现象,说明B中含有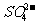 ;为了证明B中含有
;为了证明B中含有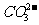 ,还应将产生的气体依次通过 、
,还应将产生的气体依次通过 、
、
|
27.(15分)有机物A、B、C均由C、H、O三种元素组成,皆满足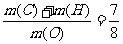 ,其相对分子质量A<B<C<l00。I的化学式是
,其相对分子质量A<B<C<l00。I的化学式是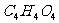 ,D-I皆为有机物。它们之间存在如下转化关系。回答下列问题:
,D-I皆为有机物。它们之间存在如下转化关系。回答下列问题:
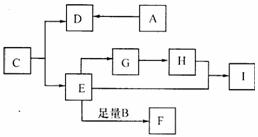
(1)C分子中官能团名称为____;I的结构简式为____。
(2)E+B F的化学方程式为
该反应的反应类型是
。
F的化学方程式为
该反应的反应类型是
。
(3)将H加入到足量澄清石灰水中,能使澄清石灰水变浑浊。该反应的化学方程式为
(4)6.0 g的B、C混合物完全燃烧消耗O2 6.4g,则B、C的质量比为 。
(5)某芳香烃式量为B的2倍,其一氯代物有两种。写出所有该烃二氯代物的结构简式:
26.(16分)铝用途广泛,用铝土矿(主要成份为A12O3·nH2O,含少量SiO2和Fe2O3)制取A1有如下途径:
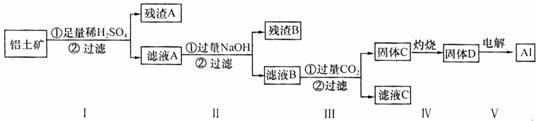
(1)滤液A可用于净水,其净水原理用离子方程式表示为: 、 __.
(2)灼烧时盛放药品的仪器名称是 。
(3)步骤V中发生反应的化学方程式是 。
(4)步骤Ⅲ中生成固体C的离子反应方程式为 ;滤液C中c(Na+)= (用电荷守恒式表达)。
(5)取滤液B
100 mL,加入1moL•L-1 HC1
200 mL,沉淀达到最大且质量为11.7g。则滤液B中c(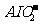 )= ,c(Na+) 2 mol•L-1(填“>”、“=”或“<”)。
)= ,c(Na+) 2 mol•L-1(填“>”、“=”或“<”)。
13.在甲、乙两个密闭容器中发生如下反应: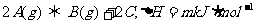 。有下列两种图像。下列叙述正确的是 ( )
。有下列两种图像。下列叙述正确的是 ( )
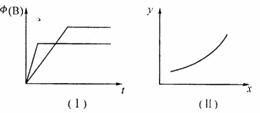
A.若甲为恒容体系,图像(Ⅰ)代表温度不同时,时间与B的体积分数关系图,则m>0
B.恒温条件下,图像(I)可能代表压强不同时,时间与B的体积分数关系图
C.恒温条件下,若乙容器存在图像(Ⅱ)关系,则当z代表压强时,y一定代表B的体积分数
D.恒温条件下,若甲、乙两容器体积相同,起始时分别向甲中充入2 mol A,乙中充1 mol B、3 mol C,则达平衡后两容器中B的体积分数一定不同
第Ⅱ卷(非选择题,共174分)
12.有酸HA和碱BOH两种溶液,下列说法正确的是 ( )
A.相同条件下,相同浓度的HA和BOH溶液,前者的c(H+)与后者的c(OH-)一定相等
B.等浓度、等体积的HA与NaA混合,溶液一定呈酸性
|
D.室温下,向lmL pH=l的HA溶液中加水至10mL,则所得溶液中水电离出的c(H+)≤1.0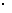 10-12mol·L-1
10-12mol·L-1
11.两种元素X、Y,其原子核外电子层数分别为a、b,最外层电子数分别为m、n。下列说法不正确的是 ( )
A.若8>m>3,则X必定为主族元素
B.若a<b<m=n=4,则晶体类型相同时,其单质熔点:Y>X
C.若Y的气态氢化物化学式为YHn,且b<4,则该氢化物为非极性分子
D.若a =b=3,8>m>n>b,则元素非金属性:X>Y
10.下列有关实验的叙述不正确的是 ( )
A.用NaCl溶液可以区分乙醇、苯、四氯化碳
B.除去溴苯中混有的Br2的方法是加NaOH溶液,分液
C.用热的饱和FeSO4溶液制备FeSO4·7H2O的步骤是:加热、蒸发、浓缩、结晶、过滤
D.为了准确测定HCl和NaOH反应的中和热,所用HC1与NaOH的体积应相同
9.肉桂醛是一种食用香精,广泛应用于牙膏、糖果及调味品中。工业上可以通过下列反应制得: ( )
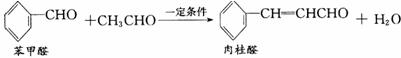
下列说法不正确的是
A.肉桂醛中所有原子可能在同一平面上
B.由苯甲醛制肉桂醛的反应经历了加成一消去反应
C.1 mol肉桂醛在一定条件下与H2加成,最多消耗5 mol H2
D.检验肉桂醛中是否残留有苯甲醛:加入酸性KMnO4溶液,看是否褪色
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com