
4.酸根离子RO3所含电子数比硝酸根离子的电子数多10,则下列说法正确的是
A.R元素和氮元素的气态氢化物的化学式分别为RH3、NH3
B.RO3中R原子的质子数为15
C.R与氮元素的原于最外层电子数不相同
D.RO3和NO3都只能被还原不能被氧化
3.1molCH4气体完全燃烧生成CO2和H2O(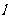 )时,放出的热量为802KJ;但当不完全燃烧生成CO和H2O(
)时,放出的热量为802KJ;但当不完全燃烧生成CO和H2O(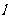 )时,放出的热量为519KJ。如果1molCH4与一定量氧气燃烧生成CO,CO2,H2O(
)时,放出的热量为519KJ。如果1molCH4与一定量氧气燃烧生成CO,CO2,H2O(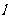 ),并放出731.25KJ的热量,则一定量的氧气的质量为
),并放出731.25KJ的热量,则一定量的氧气的质量为
A.40g B.56g C.60g D.无法计算
2.下列说法正确的是
A.水的离子积Kw随温度改变而改变,随外加酸碱浓度改变而改变。
B.一元弱酸的电离常数Ka越小,表示此温度下该一元弱酸的电离程度越大。
C.对已达到化学平衡的反应,仅改变浓度,若平衡移动则平衡常数(k)一定改变。
D.Ksp只与难溶电解质的性质和温度有关,而与溶液中的离子浓度无关。
1.关于食品添加剂的叙述不正确的是
A.醋可同时用作防腐剂和调味剂
B.亚硝酸钠可能致癌
C.我国应该禁止使用味精
D.苯甲酸钠可用作食品的防腐剂
29.(14分)(1)有机物A由碳、氢、氧三种元素组成,现取2.3gA与2.8L氧气(标准状况)在密闭容器中燃烧,燃烧后生成CO2、CO和气态H2O(假设反应物没有剩余)。将反应产生的气体依次通过浓H2SO4和碱石灰,浓H2SO4增重2.7g,碱石灰增重2.2g,则2.3gA中n(H)= mol,n(C)= mol,A的分子式为 。
(2)某课外化学活动小组设计用下图所示装置将(1)中的A氧化并检验氧化产物。
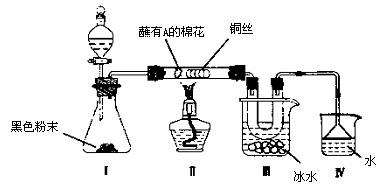
①I中黑色粉末的化学式为 。
②向锥形瓶中滴加10%H2O2水溶液,点燃II处酒精灯,观察到II中铜丝红热,此时撤去酒精灯,铜丝仍保持红热,解释其原因 。
③光亮的铜丝起 作用,II中反应的总方程式为 。
④取U型管中液体,加入到新制Cu(OH)2中,加热煮沸,发生反应的化学方程式为
。
28.(17分)已知:
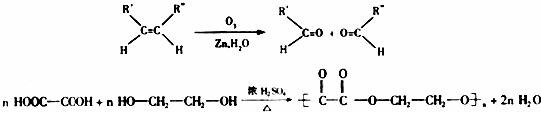
A分子式为C6H11Cl,含六元环结构,可以发生下面的转化:
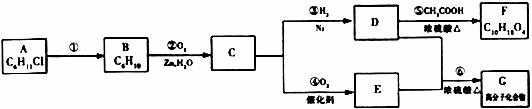
(1)C物质中含有的官能团名称是 ,反应①的条件为 。
(2)写出A、F的结构简式:A F 。
(3)写出反应③的化学方程式 。
(4)写出下列反应类型的名称:A→B C→D 。
(5)写出反应⑥的化学方程式 。
(6)分子式为G5H8O4的E的同系物共有四种,除HOOC一CH2一CH2一CH2一COOH外,其余三种的结构简式为 、 、 。
27.(16分)已知M为两种元素组成的离子化合物,其中金属元素的质量分数为35.4%,M在汽车安全气囊中有重要的作用。常温下G为淡黄色固体。H为一种常见的液体,A、B、C、X为单质,其中A、C、X为气体,A、X均为空气中成分。I、J为常见的工业原料。
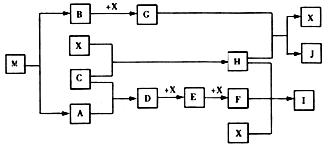
(1)写出下列物质的化学式:X 、I 、M 。
(2)写出G与H反应的化学方程式 。
(3)实验室中I应保存在棕色试剂瓶中,用化学方程式解释原因 。
(4)常温下M受撞击时可分解,13gM完全分解为A和B时,放出akJ的热量,写出M分解的热化学方程式 。
(5)M是一种易溶于水的盐,其水溶液显弱碱性,用离子方程式解释原因 。
26.(13分)H、C、N、Na、Si、Cu六种元素单质的熔点如图所示,其中单质a对应元素的一种原子是已知元素原子中质量最小的,单质c、d均是热和电的良导体。回答以下问题。
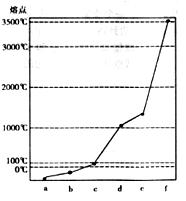
(1)写出上图中单质b的电子式 ,常温下a、f对应元素能按原子个数比1:l形成气态化合物,实验室制备该化合物的化学方程式为 。
(2)a与b对应元素原子形成的10电子分子的空间构型为 ,该分子属于 分子(填“极性”或“非极性”)。
(3)c、e、f对应元素的原子半径大小顺序为 > > (用元素符号表示)。b、e、f对应元素的最高价氧化物的水化物酸性强弱顺序为 >
> (用化学式表示)。
(4)c对应元素的最高价氧化物的水化物的水溶液与单质e反应的离子方程式为 。
13.盐酸、醋酸和碳酸氢钠是生活中常见的物质。下列表述不正确的是 ( )
A.pH=3的CH3COOH溶液和pH=11的NaOH溶液等体积混合,所得溶液pH<7
B.NaHCO3溶液中:c(H+)=c(OH-)+c(CO32-)
C.等物质的量浓度的CH3COOH溶液与NaOH溶液等体积混合后,溶液中离子的浓度由大到小的顺序是:c(Na+)>c(CH3COO-)>c(OH-)>c(H+)
D.用同浓度的NaOH溶液中和等物质的量浓度相等体积的盐酸和醋酸,消耗NaOH溶液的体积前者等于后者
非选择题
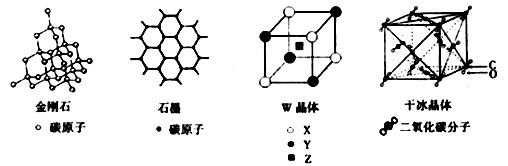
12.下列说法正确的是 ( )
A.1mol金刚石中含有4molC-C键
B.石墨晶体中碳原子数与碳碳键数的比为3:2
C.离子化合物W的晶体结构单元如图,W化学式为XYZ2
D.干冰晶体中每个最小重复单元均含有14个二氧化碳分子
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com