
11.对反应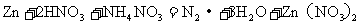 的下列说法中正确的是 (
)
的下列说法中正确的是 (
)
A.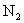 只是还原产物,
只是还原产物,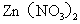 只是氧化产物
只是氧化产物
B.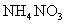 只是氧化剂,
只是氧化剂,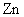 是还原剂
是还原剂
C.反应中生成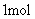
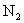 时共有
时共有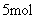 电子转移
电子转移
D.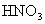 在反应中没有表现出酸性
在反应中没有表现出酸性
10.下列 说法中正确的是 ( )
说法中正确的是 ( )
A.硫酸工业、合成氨工业、玻璃工业中都涉及氧化还原反应
 B.因氨水对许多金属有腐蚀作用,所以氨水不能用金属容器盛装
B.因氨水对许多金属有腐蚀作用,所以氨水不能用金属容器盛装
C.一般合金的硬度比各成分金属要高,多数合金的熔点也比成分金属要高
D.有氧气参加的任何发光、发热的剧烈的化学反应才能称之为燃烧
9.下列离子方程式书写正确的是 ( )
A.某钾盐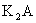 的水溶液显碱性,其原因是:
的水溶液显碱性,其原因是:
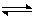

B.在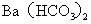 溶液中逐滴滴入
溶液中逐滴滴入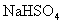 溶液至
溶液至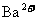 恰好完全沉淀时
恰好完全沉淀时
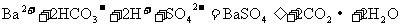
C.在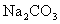 溶液中滴入过量的苯酚水溶液
溶液中滴入过量的苯酚水溶液
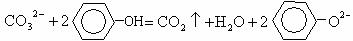
D.在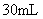
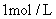 的
的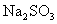 溶液中通入标准状况下的
溶液中通入标准状况下的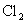
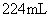
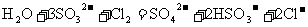
8.下列实验操作中一定会造成误差的是 ( )
A.在中和热的测定实验中用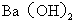 代替
代替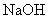 ;
;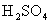 代替
代替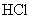
B.将pH试纸用蒸馏水湿润后测某溶液的pH
C.酸碱中和滴定实验中达到滴定终点后立即读数
D.使用天平称量时不小心将药品与砝码的位置放反了
7.下列有关阿佛加德罗常数的说法中正确的是 ( )
A.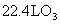 气体中一定含有
气体中一定含有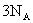 个
个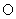 原子
原子
B.常温下80克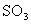 中共含有
中共含有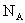 个
个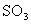 分子
分子
C.60克二氧化硅晶体中含有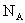 个二氧化硅分子
个二氧化硅分子
D.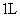
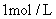 的
的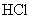 溶液中共含有
溶液中共含有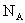 个
个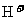
6.下列关于一些社会热点的说法中正确的是 ( )
A.奶制品中加入三聚氰胺能提高蛋白质的含量
B.新能源汽车的推广有助于减少光化学烟雾的产生
C.装饰材料中释放出来的甲醛因有杀菌消毒作用,故不是居室污染物
D.2008年末巴以战争中使用的白磷弹主要是利用了白磷的毒性
28.(14分)
(1)氨基酸是蛋白质的基石,氮基酸分子中的氨基(-NH3)显碱性。氢基酸往往形成一种两性离子,在水溶液中存在如下平衡:
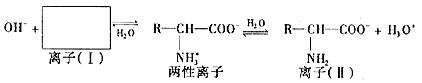
方框内所表示的离子(Ⅰ)的结构简式是 。
(2)谷氨酸的一钠盐(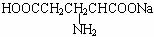 )是味精的主要成分。当前我国生产味精主要采用淀粉发酵法,其中第一步是使淀粉水解为单糖。
)是味精的主要成分。当前我国生产味精主要采用淀粉发酵法,其中第一步是使淀粉水解为单糖。
①淀粉发生水解反应的化学方程式是 。
②实验室中检验淀粉水解产物应选用的试剂是 (填字母)。
a.NaOH溶液、氨水、AgNO3溶液 b.H2SO4溶液、氨水、AgNO3溶液
c.NaOH溶液、CuSO4溶液 d.H2SO4溶液、CuSO4溶液
(3)“沙伦逊甲醛酶定法”用于测定味精中谷氨酸一钠盐的含量。将一定质量味精样品溶于水,再向溶液中加入36%甲醛溶液,反应为-NH2+HCHO→-N+CH2+H2O4再以酚酞为指示剂,用NaOH溶液进行滴定。上述测定过程中加入甲醛的目的是 。
(4)味精中常含食盐,两同学分别设计甲、乙两种方案测定味精中NaCl的含量。
①甲方案:取一定质量味精样品溶于水,加入足量稀硝酸酸化的硝酸银溶液,充分反应后,过滤、 (填缺少的步骤),称量沉淀质量,重复实验3次。
②乙方案:已知AgSCN是难溶于水的沉淀a取m g味精溶于水,加入过量浓度为c1 mol·L-1的AgNO3溶液,再加入少量 (填可能的化学式)熔液作指示剂,用浓度为c2 mol·L-1的NHSCN溶液进行滴定,当溶液变为红色时,达到滴定终点。设测定过程中所消耗的AgNO3溶液和NH4SCN溶液的体积分别为V1mL和V2mL,则该味精样品中NaCl的质量分数是 。
27.(16分)固体粉末X由Fe2O4、CaO组成。某研究性学习小组选用下图中装置(夹持仪器已略去,实验前均已检查装置气密性)探究X与过量炭粉发生反应时,除生成CO2外,是否还有其他气体产物。
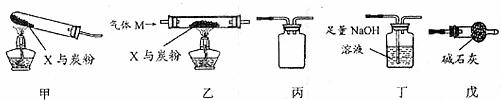
请回答:
(1)若按甲→丙→丁的顺序连接装置,则 (填上图装置代号)装置中的仪器和试剂需称量。开始反应,气体经充分吸收后,分析数据发现,消耗碳、氧元素的质量大于生成CO2的质量,可能的原因除产生了CO2外的其他气体产物,还可能是 。
(2)为使实验测得的数据更能准确说明问题,一些同学按乙→丁→戌的顺序连接装置进行实验,并且加热前先通一会儿气体M,停止加热后再通一会儿该气体。
①气体M可能是 (填字母)。
a.CO2 b.H2 c.N2 d.CO e.O2
②停止加热后再通一会儿气体M的原因是 。
(3)以上两套装置均存在同样的明显缺陷是 。
(4)该小组同学设计实验(如下图)将X进行转化(每一步均反应完全):
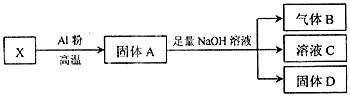
①生成气体B的化学方程式是 。
②将固体D投入过量稀硫酸并充分反应后,过滤,再向滤液加入双氧水,得黄色溶液;写出当加入双氧水时溶液中发生反应的离子方程式: 。
③若已知固体X的质量为7.2g,反应中Al粉的质量是2.7g,气体B在标准状况下的体积为672mL,则固体D的质量是 g。
26.(16分)
(1)下列事实中,能证明亚硫酸的酸性强于氢硫酸(H2S的水溶液)的是 (填字母)。
a.亚硫酸受热时易分解
b.相同条件下,亚硫酸的导电能力强于氩硫酸
c.亚硫酸溶液可使品红溶液褪色,而氢硫酸不能
d.常温下,浓度均为0.1 mol·L-1的H2SO3溶液和H2S溶液的pH分别是2:1和4:5
(2)工业上除去高压锅炉用水中溶解的氧气常用的试剂有Na2SO4和N3H4(肼)。
①已知16g液态的肼与氧气反应得到氢气和液态水时,放热354.84kJ,该反应的热化学方程式是 。
②除去等质量的O2,所耗Na2SO3和N2H4的质量比是 (填最简整数比)
(3)向Na2SO3和Na2S的混合溶液中加入稀盐酸,溶液中会产生大量淡黄色沉淀,则该反应中氧化剂和还原剂的质量之比是 。
(4)向Na2SO3溶液中滴入少量氯水后,用充分混合后的溶液证明二者发生了氧化还原反应的方法是(写出操作、试剂、现象、结论) 。
(5)已知Na2SO3在高温下发生分解,得到两种产物。某同学称量25.2g纯净的Na2SO3·7H2O(摩尔质量252g·mol-1)晶体在高温下隔绝空气加热至恒温,冷却后称得固体为12.6g,将其完全溶于水配成1L溶液,并测溶液的pH。
①测得溶液的pH大于0.1mol·L-1Na2SO3溶液的pH,原因(结合离子方程式说明)
。
②Na2SO3高温分解的化学方程式是 。
25.(14分)
(1)某芳族化物A由碳、氢、氧三种元素组成,其蒸气密度是相同条件下H2密度的69倍,已知0.1 molA在氧气中完全燃烧得30.8gCO2和0.3mol H2O,则A的分子式是 。已知A分子中苯环上有两个邻位的取代基,且A可以与NaHCO3溶液反应。则A中氧官能团的名称是 。
(2)A可以与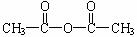 反应制得有机物B(分子式为C9H9O4,遇FeCl3溶液不能显色),该反应的化学方程式是
。
反应制得有机物B(分子式为C9H9O4,遇FeCl3溶液不能显色),该反应的化学方程式是
。
(3)已知:

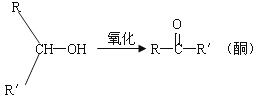 ;
;
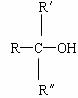 则很难被氧化(R、R/ 、R//表示甲基)。
则很难被氧化(R、R/ 、R//表示甲基)。
分子式为C3H4的烃可以发生如下图转化:
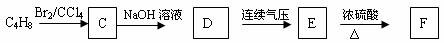
其中E、F均呈酸性。F可以与有机物B和乙二醇共同发生反应得到有机物G,由G通过加聚反应可以进一步合成分子式为(C15H15O6)2的药物H。请回答:
①写出所有符合下列条件的F的同分异构体的结构简式: 。
a.属于链状酯类 b.分子中每个碳原子上都连有氢原子
②C→D的化学方程式是 。
③H的结构简式是 。
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com