
8.若NA表示阿佛加德罗常数,下列说法正确的是 ( )
A.4.6gNO2和N2O4的混合物,所含氧原子数一定为0.2NA
B.25℃,0.2NA氦气体积不可能为4.48L
C.0.5mol NH+4所含的质子数为5NA
|
7.近年来,科学家合成了一系列具有独特化学特性的氢铝化合物(AlH3)n。已知,最简单的氢铝化合物的分子式为Al2H6,它的熔点为150℃,燃烧热极高。Al2H6球棍模型如下图。下列有关说法肯定错误的是 ( )
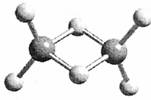
A.Al2H6在固态时所形成的晶体是分子晶体
B.氢铝化合物可能成为未来的储氢材料和火箭燃料
C.Al2H6在空气中完全燃烧,产物为氧化铝和水
D.Al2H6中含有离子键和极性共价键
6.可以判断油脂皂化反应基本完成的现象是 ( )
A.反应后静置,反应液分为两层
B.反应后静置,反应液不分层
C.反应液使蓝色石蕊试纸变红色
D.反应液使红色石蕊试纸变蓝色
22.(12分)已知X为FeO和CuO的混合物,取两份等质量的X样品进行下列实验:
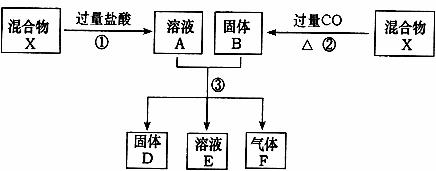
经实验测定:固体D的质量为32g,溶液E中只含有一种金属离子,且酸性较强,气体F在标准状况下体积为5.6L。
(1)固体D是 。判断依据是 。
(2)向溶液E中加入足量NaOH溶液,可观察到的现象是 。
化学方程式为 。
(3)计算取用的每份X的质量和X中的FeO和CuO的物质的量之比。
21.(12分)1L某混合溶液,可能含有的离子如下表:
|
可能大量含有的阳离子 |
H+、K+、Mg2+、Al3+、NH+4、Fe2+、Fe3+ |
|
可能大量含有的阴离子 |
Cl-、Br-、I-、ClO-、AlO-2 |
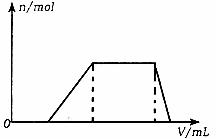
(1)往该溶液中逐滴加NaOH溶液,产生沉淀的物质的量(n)与加入NaOH溶液的体积(V)的关系如上图所示。则该溶液中确定含有的离子是 ,一定不含有的阳离子是 ,一定不存在的阴离子是 。
(2)经检测,该溶液中还含有大量的Cl-、Br-、I-,若向1L该混合溶液中通入一定量的Cl2,溶液中Cl-、Br-、I-的物质的量与通入Cl2的体积(标准状况)的关系如下表所示,分析后回答下列问题:
|
Cl2的体积(标准状况) |
2.8L |
5.6L |
11.2L |
|
n(Cl-) |
1.25mol |
1.5mol |
2mol |
|
n(Br-) |
1.5mol |
1.4mol |
0.9mol |
|
n(I-) |
amol |
0 |
0 |
①当通入Cl2的体积为2.8L时,溶液中发生反应的离子方程式为 。
②原溶液中的Cl-、Br-、I-的物质的量浓度之比为 。
20.(8分)一定温度下,将3molA气体和1molB气体通入一密闭容器中,发生如下反应:
3A(g)+ B(g) xC(g)。请填写下列空白:
xC(g)。请填写下列空白:
(1)若容器体积固定为2L,反应2min时测得剩余0.6molB,C的浓度为0.4mol/L
①2min内,A的平均反应速率为 ;x= ;
②若反应经4min达到平衡,平衡时C的浓度 0.8mol/L(填“大于”、“等于”或“小于”)
③平衡混合气物中,C的体积分数为22%,则B的转化率是 ;
(2)若维持容器压强不变,则
①达到平衡时C的体积分数 22%;
②改变起始物质加入量,欲使反应达到平衡C的物质的量是原平衡的2倍,则应加入 molA气体和 molB气体。
19.(4分)
(1)现有某金属的硝酸盐2.160g,充分加热分解生成金属氧化物0.960g和NO2、O2的混合气体0.0270mol(不考虑N2O4),则混合气体中NO2的物质的量为 mol,写出该硝酸盐分解的化学方程式,标明电子转移的方向和数目
。
(2)将x(气体)和NO2的混合气体充满一试管,倒立于水槽中,结果水面上升试管容积的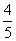 ,试回答:
,试回答:
①x可能是 (供选气体O2,NH3,HCl,NO,N2)
②当x是 或 气体时,则V(x):V(NO2)=2:3
③当x是O2时,则V(x):V(NO2)= 。
18.将4.6gNa和2.7g Al同时加入到足量的水中充分反应,将反应后的溶液稀释、定容为500mL。下列说法正确的是 ( )
A.反应中放出的气体在标准状况下的体积为2.24L
B.参加反应的水的质量与加入Al的质量相等
C.所得溶液中Na+和Al3+的物质的量之比为2:1
D.所得溶液中阳离子和阴离子的物质的量之比为1:1
第Ⅱ卷(非选择题,共46分)
17.1.0molX气体跟a mol Y气体在体积可变的密闭容器中发生如下反应:
X(g)+ a Y(g) bZ(g),反应达到平衡后,测得X的转化率为50%。而且,在同温同压下还测得反应前混合气体的密度是反应后混合气体密度的3/4,则a和b的数值可能 ( )
bZ(g),反应达到平衡后,测得X的转化率为50%。而且,在同温同压下还测得反应前混合气体的密度是反应后混合气体密度的3/4,则a和b的数值可能 ( )
A.a=1,b=2 B.a=2,b=1 C.a=2,b=2 D.a=3,b=2
16.x由NaOH、Na2SO3、Na2CO3和NaAlO2中的三种物质混合而成。取一定量X样品,投入100mL 2.4mol·L-1盐酸中,充分反应后,最终得到100mL含H+的物质的量浓度为1mol/L的溶液,若将此溶液蒸干、燃烧,得到5.70g固体。据此判断,下列说法正确的是 ( )
A.X中一定含有NaAlO2 B.X中一定不含有NaAlO2
C.X中一定不含Na2SO3或Na2CO3 D.X中一定不含NaOH
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com