
4.下列反应的离子方程式中正确的是( )
A.甲醇、氧气和氢氧化钾溶液组成的燃料电池的负极反应
CH3OH+H2O-6e-= CO2↑+6H+
B.在NaHSO4溶液中加Ba(OH)2至中性
H++SO42-+Ba2++OH-= BaSO4↓+H2O
C.苯酚钠的水溶液中通入少量的CO2
2C6H5O¯+CO2+H2O→2C6H5OH+CO32-
D.用侯氏制碱法制得NaHCO3
Na++NH3+CO2+H2O = NaHCO3↓+NH4+
3.为迎接北京2008年奥运会,从2007年起,经研制并生产的氢燃料电池公交汽车已驶入北京市街头。有关氢燃料电池的说法正确的是( )
A. 电解水制取氢气是理想而经济的制氢方法
B. 发展氢燃料电池汽车的优点之一是氢气存储方便,不存在任何安全问题
C. 氢燃料电池把氢气和氧气燃烧放出的热能转化为电能
D. 氢燃料电池汽车的使用可以有效减少城市空气污染
2.将少量苯酚晶体加入紫色石蕊试液中,溶液颜色变化情况是( )
A. 变为浅红 B. 仍为紫色 C. 变为蓝色 D. 变为无色
1.在常温常压下呈气态的化合物,降温使其固化得到的晶体属于( )
A.分子晶体 B.原子晶体 C.离子晶体 D.何种晶体无法判断
17、 国家规定FeCl3·6H2O二级品中FeCl3·6H2O质量分数不低于99%;三级品中FeCl3·6H2O质量分数不低于98%。现称取样品0.500g,用适量蒸馏水充分溶解后,向其中加少量盐酸酸化,再加过量的KI溶液使其充分反应。最后用0.100mol/L的标准Na2S2O3溶液滴定,滴定到终点时用去18.17mL标准溶液。
相关的化学方程式:2Fe3++2I–→2Fe2++I2,2Na2S2O3+I2→Na2S4O6+2NaI。请回答:
(1)滴定中所用指示剂是 ,
到达终点时的现象是 。
(2)通过计算说明此样品属于哪一级产品?
16、1912年的诺贝尔化学奖授予法国化学家V.Grignard,用于表彰他所发明的Grignard试剂(卤代烃基镁)广泛运用于有机合成中的巨大贡献。Grignard试剂的合成方法是:
RX+Mg → RMgX(Grignard试剂),生成的卤代烃基镁与具有羰基结构的化合物(醛、酮等)发生反应,再水解就能合成各种指定结构的醇:
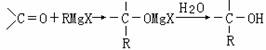
现以2-丁烯和必要的无机物为原料合成3,4-二甲基-3-己醇,进而合成一种分子式为C10H16O4的具有六元环的物质J,合成线路图如下。其中,H具有对称结构且其一氯代物只有3种。
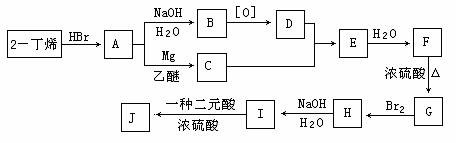
请按要求填空:
(1)D的结构简式为 、F的结构简式 ;
(2)C+D→E的反应类型是 ,H→I的反应类型是 ;
(3)写出下列化学反应方程式(有机物请用结构简式表示):
A→B ,
I→J 。
(4)I和该二元酸除了能反应生成J外,还可以在一定条件下发生缩聚反应生成高聚物,
试写出此高聚物的结构简式 。
15、实验室用丁酸和乙醇为原料,在浓硫酸存在的条件下加热制取并分离出丁酸乙酯,反应方程式及有关信息如下:
CH3CH2OH+CH3CH2 CH2COOH 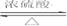 CH3CH2CH2COOC2H5+H2O
CH3CH2CH2COOC2H5+H2O
反应在该条件下进行时各物质的浓度(mol/L)随时间的变化如下表:
|
时间(min) |
CH3CH2 CH2COOH |
CH3CH2OH |
CH3CH2CH2COOC2H5 |
H2O |
|
0 |
0.3 |
0.7 |
0 |
0.3 |
|
10 |
0.23 |
a |
b |
c |
|
20 |
0.2 |
0.6 |
0.1 |
0.4 |
有关物质在101.3K Pa时沸点如下:
|
物质 |
乙醇 |
丁酸 |
丁酸乙酯 |
水 |
油 |
|
沸点(C) |
78.5 |
163.5 |
121-126 |
100 |
约250 |
(1)写出该反应的平衡常数表达式K=______________________________。
能否由题给条件判断K值随温度变化是增大还是减小___________(选填“能”或“不能”)。
(2)表中,a = ____ mol/L。50℃时,K=1/3,在20min时,反应是否达到平衡______(选填“是”或“否”)。
(3)在10~20min时,用乙醇表示的平均反应速率为_______________mol/L·min。
该反应速率比0~10min的平均反应速率小,其原因是_______________________。
(4)在起始浓度相同的情况下,要提高丁酸乙酯的产率,可采取的措施是__________________________________________________________________________。
14、现有部分短周期元素的性质或原子结构如下表:
|
元素代号 |
元素性质或原子结构 |
|
T |
M层上的电子数为6个 |
|
X |
最外层电子数是次外层电子数的2倍 |
|
Y |
常温下单质为双原子分子,其氢化物水溶液呈碱性 |
|
Z |
元素最高正价是+7 |
下列叙述正确的是
A.元素X的一种同位素可测定文物年代,这种同位素的符号是12C
B.元素Z的非金属性比元素T弱
C.Y和T位于同一主族
D.T、X、Y、Z四种元素的最高价氧化物水化物中化学性质明显不同于其它三种的是碳酸
13、下列操作会使实验结果偏高的是
A.用已知浓度的氢氧化钠滴定盐酸时,酸式滴定管放液前未排气
B.硫酸铜结晶水含量的测定实验中,灼烧后晶体已部分变黑
C.中和热测定实验中,倒入氢氧化钠过于迟缓
D.配制一定物质的量浓度溶液,定容时仰视读数
12、三氯生的化学名为2,4,4-三氯-2-羟基二苯醚,被广泛应用于肥皂、牙膏等日用化学品之中,有杀菌消毒等作用。则下列有关说法中不正确的是
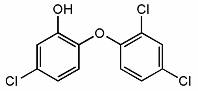
A.物质的分子式为C12H6Cl3O2
B.该物质与FeCl3溶液混合后可显色。
C.该物质中所有原子一定处于同一平面
D.该物质苯环上的一溴取代物有6种
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com