
1、(6分)曾经风靡美国的苹果醋,主要成分为2一羟基丁二酸。苹果酸毒性极低,并且对动物的记忆获得、巩固和再现均有明显的改善作用并能够促进正常生物的空间辨别学习能力。
苹果酸的结构简式为HOOC-CHOH-CH2-COOH。
回答下列问题:
(1)苹果酸分子中所含的官能团名称是_________;
(2)苹果酸可以发生的化学反应有_________ (填序号)。
①水解反应 ②取代反应 ③氧化反应 ④消去反应 ⑤加聚反应
(3)苹果酸与醋酸发生酯化反应的化学方群式为(请注明反应条件)________________。
4、(4分)称取2份一定质量的锌,分别盛在2支试管中,按下列要求另加物质后,塞上带导管的塞子,定时浊定生成氢气的体积。
A、试管中加入pH=3的盐酸50mL:
B、试管中加入pH=3的醋酸50mL:
若反应终了时生成的氢气一样多,且没有剩余的锌。那么,
(1)开始时反应速率的大小为_________ (填“<”、“>”或“=”,下同)。
(2)2支试管中参加反应的锌的质量_________。
(3)反应终了所需时间__________________。
有机化学基础模块
3、(6分)海水中主要含有Na+、K+、Ca2+、Mg2+、Cl-、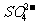 、Br-、
、Br-、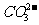 、
、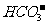 等离子。合理利用海水资源和保护环境是实现可持续发展的重要保证。
等离子。合理利用海水资源和保护环境是实现可持续发展的重要保证。
(1)天然海水的pH≈8,呈弱碱性。用离子方程式解释原因__________________(任写一个)
(2)重金属离子对河流海洋造成严重污染。某化工厂废水(pH=2.0,p≈1.0g·m L-1)含有Ag+、Pb2+等重金属离子,其浓度均约为0.01mol·L-1。排放前拟用沉淀法除去这两种离子,查找有关数据如下:
|
难溶电解质 |
AgI |
AgOH |
Ag2S |
PbI2 |
Pb(OH)2 |
PbS |
|
KSP |
8.3×10-l7 |
5.6×10-8 |
6.3× 10-50 |
7.1×10-9 |
1.2×10-l5 |
3.4×10-28 |
①你认为往废水中投入_________(填字母序号),沉淀效果最好。
A、NaOH B、Na2S C、Kl D、Ca(OH)2
②如果用生石灰处理上述废水,使溶液的pH=8.0,处理后的废水中c(Pb2+)=_________。
2、(8分)如图所示有A、B、C三个装置:
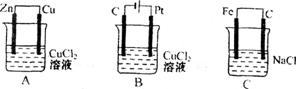
(1)A 池中Zn是_______极,Cu电极反应为_______
(2)B 池中C是_______极,B池中总的化学方程式为_______
(3)C池放置数天后主要发生______________电化学腐蚀,写出正极的电极反应式_____________________。
1、(6分)液化石油气的主要成分是丙烷,丙烷燃烧生成2mol液态H2O时放热1110KJ,则表示燃烧热的热化学方程式为:_____________________。又知CO气体燃烧的热化学方程式为:CO(g)+1/2O2(g)=CO2(g);△H=-282.57kj·mol-1试比较同物质的量的C2H8和CO燃烧,产生的热量比值约为___________________________________。
21、(4分)在标准状况下,进行甲、乙、丙三组实验:三组各取60mL同浓度盐酸溶液,加入同一种镁铝合金粉末,产生气体,有关数据列表如下:
|
实验序号 |
甲 |
乙 |
丙 |
丁 |
|
合金质量/mg |
510 |
770 |
918 |
1000 |
|
气体体积/mL |
560 |
672 |
672 |
|
(1)丁中生成气体的体积为_______。
(2)该盐酸的物质的量浓度为_______。
第Ⅲ卷(非选择题共24分)
化学反应原理:
20、(7分)A、B、C三种元素的原子具有相同的电子层数,B的核电荷数比A大2,C原子的电子总数比B原子电子总数多4,1molA的单质跟盐酸反应可置换出11.2L(标准状况)氢气,这时A转变成与氖原子具有相同电子层结构的离子。试回答:
(1)A是_______元素,B是_______元素,C是_______元素。
(2)写出A、B的最高价氧化物对应水化物之间反应的化学方程式______________。
19、(3分)1mol分子组成为C3H8O的液态有机物A,与足量的金属钠作用,可生成11.2L(标准状况)氢气,则A分子中必有一个_______基,若此基在碳链的一端,则A的结构简式为_______。与醋酸发生酯化反应生成酯的结构简式_______。
18、(8分)为了探究“二氧化碳是否在水存在时才能和过氧化钠反应”,某课题研究小组的同学们设计了如下图的实验装置,分别进行了甲、乙两次实验:
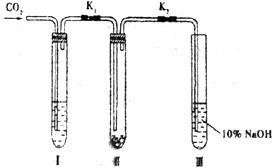
实验甲:干燥的二氧化碳和过氧化钠的反应。在干燥的试管Ⅱ中装入Na2O2,在通入CO2之前,关闭Kl和K2。在试管Ⅰ内装入试剂X后,打开Kl和K2,通入CO2,几分钟后,将带火星的木条插入试管Ⅲ的液面上,观察到木条不复燃,且Ⅱ中的淡黄色没有变化。
实验乙:潮湿的二氧化碳和过氧化钠的反应。在试管I内装入试剂Y,其他操作同实验甲。观察到木条复燃,且Ⅱ中的淡黄色变为白色。
试回答下列问题:
(1)在装入Na2O2后,通入CO2前,关闭Kl和K2的目的是________________________。
(2)在实验甲中,试剂X是_______;在实验乙中,试剂Y是_______。
(3)根据上述两个实验现象,得到的结论是_______。
(4)为了确保实验现象的准确性,制备CO2所用的反应物最好选用_______ (填序号,多选扣分)。
A、大理石 B、小苏打 C、烧碱 D、盐酸 E、稀硫酸 F、稀硝酸
17、(6分)实验室欲用固体NaOH配制240mL 2 mol/L的NaOH溶液,试回答:
(1)用不到的仪器是__________。(填序号)
A、烧杯 B、250mL容量瓶 C、量筒 D、胶头滴管 E、玻璃棒
F、100mL容量瓶 G、托盘天平
(2)配制时应称取NaOH__________g。
(3)溶液转入容量瓶前需检验容量瓶 ___________。
(4)该实验的顺序是___________。(用字母表示)
A、冷却 B、称量 c、计算 D、定容 E、溶解 F、倒转摇匀
G、移液 H、将洗涤溶液转移到容量瓶中
(5)①若定容时俯视刻度线,则实验结果将 。(填“偏大”、“偏小’’或“不受影响”,下同)
②若未恢复到室温就转移定容,则实验结果将__________。
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com