
34.[化学-有机化学基础](15分)
根据下面的反应路线及所给信息填空。
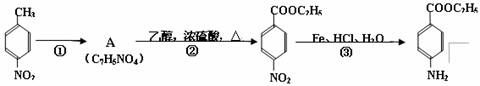
(1)① 的反应条件是: 。 ② 的反应类型是: 。 (苯佐卡因)
(2)反应②的化学方程式: 。
(3)苯佐卡因有多种同分异构体,其中-NH2直接连在苯环上,分子结构中含有-COOR
官能团,且苯环上的一氯取代物只有两种的同分异构体共有六种,除苯佐卡因外,其中两种的结构简式是:
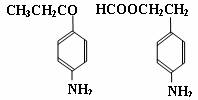
则剩余三种同分异构体的结构简式为: 、 、 。
33.[化学-物质结构](15分)
有A、B、C、D、E、F、G七种元素,除E为第四周期元素外,其余均为短周期元素。A、E、G位于周期表s区,其余元素位于p区。
|
元素原子 |
性质和结构特点 |
|
A |
A原子没有成对电子 |
|
B |
基态原子中电子占据三种能量不同的原子轨道,且每种轨道中的电子总数相同 |
|
C |
外围电子层排布式为nsnnpn+1 |
|
D |
第一电离能列同周期主族元素的第三高 |
|
E |
与A原子外围电子层相同 |
|
F |
核外成对电子数是成单电子数的3倍 |
|
G |
基态原子占据两种形状的原子轨道,且两种形状轨道中的电子总数均相同 |
(1)写出下列元素符号:B D
(2)D同周期的前一元素第一电离能高于D的原因:
(3)由A、B、C形成的ABC分子中,含有 个σ键, 个π键;
(4)由D、E、F、G形成的盐E2DF4、GDF4是 晶体。且 的熔点高(写化学式);
27. (15分)某强酸性反应体系中,反应物和生成物共六种物质:O2 、MnO4-、H2O 、Mn2+ 、H2O2
、H+ 。已知该反应中H2O2
只发生了如下过程:H2O2
→O2。
(15分)某强酸性反应体系中,反应物和生成物共六种物质:O2 、MnO4-、H2O 、Mn2+ 、H2O2
、H+ 。已知该反应中H2O2
只发生了如下过程:H2O2
→O2。
 (1)该反应应选择的酸是:
(填序号)。
(1)该反应应选择的酸是:
(填序号)。
A.盐酸 B.浓硫酸
C.稀硫酸 D.醋酸。
 (2)该反应中发生还原反应的过程是:
→ 。
(2)该反应中发生还原反应的过程是:
→ 。
 (3)写出该反应配平的离子方程式并标出电子转移的方向和数目:
(3)写出该反应配平的离子方程式并标出电子转移的方向和数目:
(4)如果上述反应中有6.72L(标准状况.)气体生成,转移的电子数为 mol。
 (5)H2O2有时可作为矿业废液消毒剂,有“绿色氧化剂”的美称;如消除采矿业胶液中的氰化物(如KCN),经以下反应实现:KCN + H2O2+H2O
= A + NH3↑,试指出生成物A的化学式为 ,并阐明H2O2被称为绿色氧化剂的理由是 。
(5)H2O2有时可作为矿业废液消毒剂,有“绿色氧化剂”的美称;如消除采矿业胶液中的氰化物(如KCN),经以下反应实现:KCN + H2O2+H2O
= A + NH3↑,试指出生成物A的化学式为 ,并阐明H2O2被称为绿色氧化剂的理由是 。
选考题
26.(12分)有A、B、C、D、E、F六瓶不同物质的溶液,它们各是NaOH、(NH4)2CO3、BaCl2、AgNO3、HCl和MgSO4溶液中的一种。为了鉴别,各取少量溶液进行两两混合,实验结果如表所示。其中“↓”表示生成沉淀或微溶化合物,“↑”表示生成气体或受热挥发出碱性气体的化合物,“-”表示观察不到明显变化。试回答下列问题。
|
|
A |
B |
C |
D |
E |
F |
|
A |
- |
- |
↓ |
↑ |
- |
- |
|
B |
- |
- |
↓ |
↓ |
↓ |
↓ |
|
C |
↓ |
↓ |
- |
↓ |
↓ |
↓ |
|
D |
↑ |
↓ |
↓ |
- |
↓ |
↑ |
|
E |
- |
↓ |
↓ |
↓ |
- |
- |
|
F |
- |
↓ |
↓ |
↑ |
- |
- |
(1)写出A--F物质的化学式。(各1分)
A: ,B: ,C:
D: ,E: ,F:
(2)写出下列反应的离子方程式。(各2分)
A与D反应: C与E反应:
B与F反应:
25.(16分).某化学小组欲探究铁及其化合物的氧化性和还原性,请回答下列问题:
试剂:铁粉、FeCl3溶液、FeCl2溶液、氯水、锌片、铜片、KSCN溶液。
(1)除胶头滴管外,你认为本实验必不可缺少的一种玻璃仪器是________________。
(2)实验记录(划斜线部分不必填写):
|
序号 |
实验内容 |
实验现象 |
离子方程式 |
实验结论 |
|
① |
在FeCl2溶液中滴入适量氯水 |
溶液由浅绿色变为棕黄色 |
A |
Fe2+具有还原性 |
|
② |
在FeCl2溶液中加入锌片 |
|
Zn+Fe2+=Zn2++Fe |
B |
|
③ |
在FeCl3溶液中加入足量铁粉 |
C |
Fe+2Fe3+=3Fe2+ |
Fe2+具有氧化性 Fe具有还原性 |
|
④ |
D |
|
E |
Fe3+具有氧化性 |
实验结论:Fe只有还原性,Fe3+只有氧化性,Fe2+既有氧化性,又有还原性。
(3)亚铁盐在溶液中易被氧化,而实验室中需要纯净的亚铁盐溶液。那么保存亚铁盐溶液时应该如何防止亚铁盐被氧化__________________________________________,并简述Fe2+的检验的方法____________________________________________。
13.下列表示溶液中发生反应的化学方程式错误的是 ( )
A.MnO2+4HCl(浓) MnCl2+Cl2↑+2H2O
MnCl2+Cl2↑+2H2O
B.K2Cr2O7+6FeSO4+7H2SO4=Cr2(SO4)3+3Fe2(SO4)3+K2SO4+7H2O
C.2Al+2NaOH+2H2O=2NaAlO2+3H2↑
D.2KMnO4+HCOOK+KOH=2K2MnO4+CO2↑+H2O
第Ⅱ卷(非选择题)
必考题
12.下列关于氯的说法正确的是 ( )
A.Cl2具有很强的氧化性,在化学反应中只能作氧化剂
B.若35 17Cl、37 17Cl为不同的核素,有不同的化学性质
C.实验室制备Cl2,可用排饱和食盐水集气法收集
D.1.12LCl2含有1.7NA个质子(NA 表示阿伏伽德罗常数)
11.制印刷电路时常用氯化铁溶液作为“腐蚀液”,发生的反应2FeC13+Cu=2FeCl2+CuCl2向盛有氯化铁溶液的烧杯中同时加入铁粉和铜粉,反应结束后,下列结果不可能出现的是
( )
A.烧杯中有铜无铁 B.烧杯中有铁无铜
C.烧杯中铁、铜都有 D.烧杯中铁、铜都无
10.NA代表阿伏加德罗常数,下列说法正确的是 ( )
A.7.1g氯气与足量NaOH溶液反应电子转移数为0.2NA
B.标准状况下,22.4L辛烷完全燃烧生成二氧化碳分子数为8NA
C.常温下,2.7g铝与足量的盐酸反应,失去的电子数为0.3NA
D.等体积、浓度均为1mol/L的磷酸和盐酸,电离出的氢离子数之比为3∶1
9.下列除去杂质的方法正确的是 ( )
|
|
物 质 (杂 质) |
除 杂 方 法 |
|
A |
Cl2(HCl) |
将气体通过盛有氢氧化钠溶液的洗气瓶 |
|
B |
CO2(HCl) |
将气体通过盛有饱和Na2CO3溶液的洗气瓶 |
|
C |
氢氧化铁胶体(FeCl3) |
将混合物直接过滤 |
|
D |
SiO2
(CaCO3) |
加入盐酸后过滤 |
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com