
13.下列关于原电池的叙述正确的是( )
A.构成原电池的正极和负极必须是两种不同的金属
B.原电池是将化学能转变为电能的装置
C.原电池中电子流出的一极是负极,该极被还原
D.原电池放电时,电流的方向是从负极到正极
12.已知热化学方程式:H+(aq)+OH-(aq)= H2O (l) △H 1= -57.3 kJ/mol
1/2H2SO4(浓)+ NaOH(aq)= 1/2 Na2SO4(aq)+ H2O (l) △H 2 = m,下列说法正确的是( )
A.上述热化学方程式中的计量数表示分子个数 B.△H 1 > △H 2
C.m = -57.3 kJ/mol D.∣△H 1 ∣ >∣△H 2∣
11.以MnO2为原料制得的MnCl2溶液中常含有Cu2+、Pb2+、Cd2+等金属离子,通过添加过量难溶电解质MnS,可以使这些金属离子形成硫化物沉淀,经过滤除去包括MnS在内的沉淀,再蒸发、结晶,可得纯净的MnCl2。根据上述实验事实,可推知MnS具有的相关性质( )
A.吸附性 B.溶解度与CuS、PbS、CdS相同
C.溶解度大于CuS、PbS、CdS D.溶解度小于CuS、PbS、CdS
10.某溶液中AlCl3的水解反应已达平衡:AlCl3+3H2O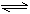 Al(OH)3+3HCl ,若要使AlCl3的水解程度增大,应采取的方法是( )
Al(OH)3+3HCl ,若要使AlCl3的水解程度增大,应采取的方法是( )
A.加入NaHCO3 B.加入NaHSO4 C.加AlCl3固体 D.降温
9.在CH3COOH 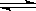 CH3COO―+H+的电离平衡中,要使平衡向右移动且氢离子浓度增大,应采取的措施是 ( )
CH3COO―+H+的电离平衡中,要使平衡向右移动且氢离子浓度增大,应采取的措施是 ( )
①加入H2SO4 ②加入NaOH ③加入CH3COONa ④加入水 ⑤升高温度
A.②④⑤ B.①③ C.②④ D.只有 ⑤
8.一定温度下,在一密闭容器中发生可逆反应:A(g)+3B(g) 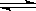 2C(g),下列不能作为该反应达到平衡的标志的是( )
2C(g),下列不能作为该反应达到平衡的标志的是( )
A.A的分解速率等于A的生成速率 B.容器内的压强不再变化
C.混合气体的平均相对分子质量不再变化 D.A、B、C的浓度之比为1:3:2
7.能影响水的电离平衡,并使溶液中的c(H+)>c(OH-)的操作是( )
A.向水中投入一小块金属钠 B.将水加热煮沸
C.向水中通入二氧化碳气体 D.向水中加食盐晶体
6.下列溶液一定呈碱性的是( )
A.溶液中c(OH-)>c(H+) B.pH>7的溶液
C.含有OH-的溶液
D.pH=5的CH3COOH溶液加水稀释1000倍后所得的溶液
5.一定条件下发生下列反应,其中属于盐类水解反应的是( )
A.NH4++2H2O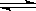 NH3·H2O
+ H3O+
NH3·H2O
+ H3O+
B.HCO3- + H2O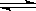 H3O+ + CO32-
H3O+ + CO32-
C.HS-+H+═ H2S
D.Cl2+H2O 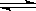 H++Cl-+HClO
H++Cl-+HClO
4.2L的密闭容器中进行如下反应:N2 +
3H2  2NH3,在5s内中N2减少了0.8mol。,则该5s内NH3的平均反应速率是( )
2NH3,在5s内中N2减少了0.8mol。,则该5s内NH3的平均反应速率是( )
A.0.24 mol/(L·s) B.0.16mol/(L·s)
C.0.08 mol/(L·s) D.0.32 mol/(L·s)
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com