
8.在下列溶液中,各组离子一定能够大量共存的是 ( )
A.含有0.1 mol·L-1 Ca2+溶液在中:Na+、K+、CO32-、Cl-
B.c(H+)=10-12mol·L-1的溶液:K+、Ba2+、Cl-、Br-
C.使紫色石蕊试液变红的溶液:Na+、Fe2+、NO3-、Cl-
D.碳酸氢钠溶液:K+、SO2-4、Cl-、H+
7.图标 所警示的是 ( )
所警示的是 ( )
A.当心火灾--氧化物 B.当心火灾--易燃物质
C.当心爆炸--自燃物质 D.当心爆炸--爆炸性物质
26.在一固定容积的密闭容器中,保持一定温度,在一定条件下进行以下反应:A(g)+2B(g) 3C(g),已知加入1molA和3molB且达到平衡后,生成了a molC。
3C(g),已知加入1molA和3molB且达到平衡后,生成了a molC。
(1)达到平衡时,C在反应混合气中的体积分数是________(用含字母a的代数式表示)。
(2)在相同实验条件下,若在同一容器中改为加入2molA和6 mol B,达到平衡后,C的物质的量为________mol(用含字母a的代数式表示),此时C在反应混合气中的体积分数与原平衡相比________(选填“增大”“减小”或“不变”)。
(3)在相同实验条件下,若在同一容器中改为加入2 mol A和8 mol B,若要求平衡后C在反应混合气中体积分数仍与原平衡相同,则还应加入C________mol。
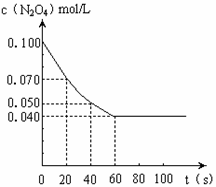
25.在温度为373K时,将0.100mol无色的N2O4气体放入1L抽空的密闭容器中,立刻出现红棕色,直至建立N2O4
 2NO2的平衡。下图是隔一定时间测定到的N2O4的浓度(纵坐标为N2O4的浓度,横坐标为时间)
2NO2的平衡。下图是隔一定时间测定到的N2O4的浓度(纵坐标为N2O4的浓度,横坐标为时间)
(1)计算在20至40秒时间内,NO2的平均生成速率为__________mol•L-1•S -1。
(2)该反应的化学平衡常数表达式为K=_________。
(3)下表是不同温度下测定得到的该反应的化学平衡常数。
|
T/ K |
323 |
373 |
|
K值 |
0.022 |
0.36 |
据此可推测该反应(生成NO2)是__________反应(选填“吸热”或“放热”)。
24.(1)在25℃时, 有pH=a的盐酸和pH=b的苛性钠溶液,现取VamL盐酸用该苛性钠溶液VbmL刚好中和。若a+b=13,则Va/Vb=____________。
(2)将pH=3的弱酸溶液稀释100倍,该溶液的pH范围为:__________ 。
23.(1)稀强酸、稀强碱反应生成1mol液态水时放出57.3 kJ的热量。
①实验室中可用稀盐酸和氢氧化钡稀溶液反应来测定中和热。请写出能表示该反应中和热的热化学方程式_______;
② 分别取100 mL 0.50 mol/L盐酸与100 mL 0.55 mol/L NaOH溶液进行中和反应。通过测定反应过程中所放出的热量可计算中和热。假设盐酸和氢氧化钠溶液的密度都是1g/cm3,中和后生成溶液的比热容c = 4.18 J/(g·℃)。实验时,测得反应前盐酸与NaOH溶液的平均温度为21.5℃,反应后混合溶液的温度为24.9℃。
则实验测得的中和热△H=_______(保留1位小数);
③ 如果用含1 mol CH3COOH的稀醋酸与足量稀氢氧化钠溶液反应,反应放出的热量____57.3 kJ(填“大于”、“小于”或“等于”);理由是_____________________________。
(2)在催化剂的作用下CH4还原NO可以得到三种产物(该条件下均为气体),利用此反应能消除环境污染物NO。理论上每消耗标况下22.4 L NO就能放出290 kJ的热量。写出该反应的热化学方程式____________________________。
22.反应A(g)+B(g)  C(g) +D(g)过程中的能量变化如图所示,回答下列问题。
C(g) +D(g)过程中的能量变化如图所示,回答下列问题。
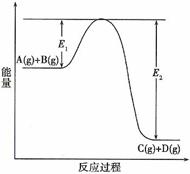
(1)该反应是____________________反应(填“吸热”、“放热”)。
(2)当反应达到平衡时,升高温度,A的转化率______(填“增大”、“减小”或“不变”),原因是____________________________________________。
(3)反应体系中加入催化剂对反应热是否有影响?_________,原因是_________。
(4)在反应体系中加入合适催化剂,反应速率增大,E1和E2的变化是:E1_________,E2________(填“增大”、“减小”或“不变”)。
21.在一定条件下,可逆反应:mA+nB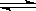 pC达到平衡,若:
pC达到平衡,若:
(1)A、B、C都是气体,减少压强,平衡向正反应方向移动,则m+n和p的关系是_______ 。
(2)A、C是气体,增加B的量,平衡不移动,则B为 _______态。
(3)A、C是气体,而且m+n=p,增大压强可使平衡发生移动,则平衡移动的方向是 _______
(4)加热后,可使C的质量增加,则逆反应是_______反应(放热或吸热)。
20.将固体NH4I置于密闭容器中,在一定温度下发生下列反应:
①NH4I(s)
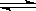 NH3(g)+HI(g);②2HI(g)
NH3(g)+HI(g);②2HI(g) 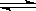 H2(g)+I2(g)
H2(g)+I2(g)
达到平衡时,c(H2)=0.5mol·L-1,c(HI)=4mol·L-1,则此温度下反应①的平衡常数为( )
A.9 B.16 C.20 D.25
第Ⅱ卷
19.在常温下,由水电离产生的H+浓度为1×10-13mol·L-1的溶液中,一定能大量共存的离子组是( )
① K+、Cl-、NO3-、S2- ② K+、Fe2+、I-、SO42-
③ Na+、Cl-、NO3-、SO42- ④Na+、Ca2+、Cl-、HCO3-
⑤ K+、Ba2+、Cl-、NO3-
A.①③ B.③⑤ C.③④ D.②⑤
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com