
5.下列溶液肯定显酸性的是 ( )
A.含H+的溶液 B.能使酚酞呈无色的溶液
C.pH<7的溶液 D.c(OH-)<c(H+)的溶液
4.充分燃烧一定量丁烷时放出的热量xQ,完全吸收它生成的CO2生成正盐,需5mol/L的KOH溶液100ml,则丁烷的燃烧热为 ( )
A.16xQ B.8xQ C.4xQ D.2xQ
3.在0.1mol·l-1CH3COOH溶液中的H+浓度为 ( )
A.0.1mol·l-1 B.大于0.1mol·l-1
C.小于0.1mol·l-1 D.等于0
2.有如下两个反应: ( )
① 2HCl H2+Cl2
H2+Cl2
② 2HCl H2↑+Cl2↑
H2↑+Cl2↑
关于这两个反应的叙述中错误的是
A.①②两反应都是氧化还原反应
B.①②两反应中的能量转换方式都是热能转变为化学能
C.②反应是电能转变为化学能
D.①反应是热能转变为化学能
1.可逆反应N2+3H2 2NH3的正、逆反应速率可用各反应物或生成物浓度的变化来表示。下列各关系中能说明反应已达到平衡状态的是 ( )
2NH3的正、逆反应速率可用各反应物或生成物浓度的变化来表示。下列各关系中能说明反应已达到平衡状态的是 ( )
A.3υ正(N2)=υ正(H2) B.υ正(N2)=υ逆(NH3)
C.2υ正(H2)=3υ逆(NH3) D.υ正(N2)=3υ逆(H2)
26.(10分)用沉淀法测定NaHCO3和K2CO3混合物的组成。实验过程是每次称取一定质量的样品溶于水制成溶液,向其中滴加相同浓度的Ba(OH)2溶液,每次实验均充分反应。实验记录见下表:
|
实验次数 |
称取样品的质量/g |
所加Ba(OH)2溶液的体积/L |
测得生成沉淀质量/g |
|
1 |
0.858 |
0.5 |
1.379 |
|
2 |
1.716 |
0.5 |
|
|
3 |
2.574 |
0.5 |
4.137 |
|
4 |
3.432 |
0.5 |
5.516 |
|
5 |
4.290 |
0.5 |
5.516 |
|
6 |
5.148 |
0.5 |
5.516 |
回答下列问题:
(1)写出少量NaHCO3和过量Ba(OH)2溶液反应的离子方程式:_________________;
(2)第2次实验中产生沉淀质量是__________g,
(3)样品中NaHCO3和K2CO3的物质的量之比是___________________;
(4)原Ba(OH)2溶液的浓度为___________________mol/L;
(5)室温下取第3组实验所得溶液体积的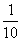 ,加水配成500mL溶液,则稀释以后溶液的pH为_________。
,加水配成500mL溶液,则稀释以后溶液的pH为_________。
25.(10分)近年来,浙江省酸雨污染较为严重,防治酸雨成了迫在眉睫的问题。
(1)有人提出了一种利用氯碱工业产品治理含二氧化硫废气的方法,流程如下:
Ⅰ:将含SO2的废气通入电解饱和食盐水所得溶液中,得NaHSO3溶液。
Ⅱ:将电解饱和食盐水所得气体反应后制得盐酸。
Ⅲ:将盐酸加入NaHSO3溶液中得SO2气体回收,生成的NaCl循环利用。
① 写出步骤(I)反应的化学方程式: ;
② 写出步骤(III)反应的离子方程式: ;
(2)还有学者提出利用 Fe 2十、Fe3十等离子的催化作用,常温下将SO2氧化成SO42一而实现SO2的回收利用。某研究性学习小组据此设计了如下方案,在实验室条件下测定转化器中SO2氧化成SO42一的转化率。
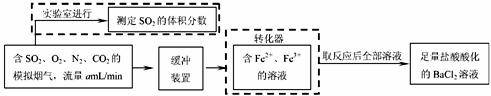
① 该小组采用下图装置在实验室测定模拟烟气中SO2的体积分数,X溶液可以是(填序号) 。
A.碘的淀粉溶液 B.酸性高锰酸钾溶液
C.氢氧化钠溶液 D.氯化钡溶液
② 若上述实验是在标准状况下进行的,X是已知体积和物质的量浓度的溶液,欲测定转化器中SO2氧化成SO42-的转化率,已知气体流速,还需测定的数据是 。
(3)为进一步减少SO2的污染并变废为宝,人们正在探索用CO还原SO2得到单质硫的方法来除去SO2。该方法涉及到的化学反应为:SO2+2CO=2CO2+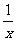 Sx
Sx
CO+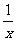 Sx=COS、2COS+SO2=2CO2+
Sx=COS、2COS+SO2=2CO2+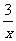 Sx 。其中COS中“C”化合价为 。
Sx 。其中COS中“C”化合价为 。
(4)若生活污水中含大量的氮化合物,通常用生物膜脱氮工艺进行处理:首先在消化细菌的作用下将NH4+氧化为NO3-:NH4++2O2=NO3-+2H++H2O,然后加入甲醇,NO3-和甲醇转化为两种无毒气体。请写出加入甲醇后反应的离子方程式 。
24.(10分)1 L某混合溶液,可能含有的离子如下表:
|
可能大量含有的阳离子 |
H+ NH4+ Al3+ K+ |
|
可能大量含有的阴离子 |
Cl- Br- I‑ ClO‑ AlO2- |
(1)往该溶液中逐滴加入NaOH溶液并适当加热,产生沉淀和气体的物质的量(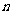 )
)
与加入NaOH溶液的体积(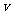 )的关系如下图所示。
)的关系如下图所示。
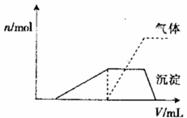
则该溶液中确定含有的离子有_______________;
不能确定是否含有的阳离子有__________,
要确定其存在可补充做的实验是________;
肯定不存在的阴离子有___________。
(2)经检测,该溶液中含有大量的Cl- 、Br-、I-,若向1 L该混合溶液中通入-定量的Cl2,溶液中Cl-、Br-、I-的物质的量与通入Cl2的体积
|
Cl2的体积(标准状况) |
2.8L |
5.6 L |
11.2 L |
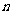 (Cl-) (Cl-) |
1.25mol |
1.5 mol |
2 mol |
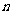 (Br-) (Br-) |
1.5 mol |
1.4 mol |
0.9 mol |
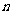 (I-) (I-) |
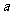 mol mol |
0 |
0 |
①当通入Cl2的体积为2.8 L时,溶液中发生反应的离子方程式为____ __。
②原溶液中Cl-、Br-、I-的物质的量浓度之比为____________________________。
23.(8分)有两份溶液,其中所含溶质相同,设其摩尔质量为Mg/mol。根据下表信息,回答有关问题:
|
|
溶质的质量分数 |
溶液的密度(g·cm-3) |
|
第一份溶液 |
ω1 |
ρ1 |
|
第二份溶液 |
ω2 |
ρ2 |
(1)第一份溶液中,溶质的物质的量浓度为 。
(2)取等质量两份溶液混合,则所得混合液中溶质的质量分数ω3= 。
(3)若有ω1>ω2,取等体积的两份溶液混合,设所得混合液中溶质的质量分数为ω4,试比较ω3、ω4的相对大小?
① ② 。
1.47 g/mL),它的物质的量浓度为 ;
(5)在“反应液I”中加KOH固体的目的是 :
A.与“反应液I”中过量的Cl2继续反应,生成更多的KClO
B.KOH固体溶解时会放出较多的热量,有利于提高反应速率
C.为下一步反应提供反应物
D.使副产物KClO3转化为 KClO
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com