
2.味精中有效成分是谷氨酸钠,可用沙伦逊甲醛滴定发测定其含量。准确称取味精1.000g,加蒸馏水溶解后稀释到10.0mL;从中取2.0mL放入100mL锥形瓶中,加入2.0mL 36%的甲醛溶液,加入20mL水。以酚酞为指示剂,用0.1000mol/L的标准NaOH溶液进行滴定,消耗10.80mL。
(1)谷氨酸钠与甲醛反应得到化学式为C6H8NO4Na,写出结构简式。(2)加入甲醛的目的是什么?(3)计算该味精中谷氨酸钠的含量。
1.谷氨酸的电离常数Ka1=6.46×10-3,Ka2=5.62×10-5,Ka3=2.14×10-10;pKa=-lgKa,所以pKa1=2.19,pKa2=4.25,pK3=9.67。
目前工业上生产味精的方法有水解法、糖蜜提取法、淀粉发酵法及合成法等。当前我国生产的味精主要采用淀粉发酵法。
以发酵法生产的工艺流程如下:淀粉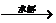 葡萄糖
葡萄糖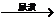 发酵
发酵 谷氨酸铵
谷氨酸铵 L-谷氨酸
L-谷氨酸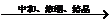 谷氨酸-钠盐。
谷氨酸-钠盐。
若生成谷氨酸二钠盐,则不具有鲜味,所以工业生产中控制各阶段的pH是一项关键。
(1)Ka1、Ka2、Ka3相对应的基团各是哪个?
(2)计算谷氨酸等电点的pH(所谓等电点,就是谷氨酸呈电中性时所处环境的pH)。在下面正确的选项上画圈。A 2.19 B 3.22 C 4.25 D 6.69
(3)中和、脱色、结晶时的pH应保持在多少?在下面正确的选项上画圈。
A 3.22 B 4.25 C 6.69 D 9.67
(4)用什么物质脱色?[ ]
5.另有一种晶体Y,其阴离子也组成立方最密堆积,且与X的阴离子互为等电子体,而阳离子与X的阳离子相同,但只占据全部四面体空隙,请写出Y的化学式。
第[五]题(12分)1866年H. Rithausen从谷胶的硫酸分解产物中分离出谷氨酸,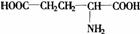 。1890年L. Wollf合成并确定了它的结构,1908年池田菊苗从海带的热水提取物中分离出谷氨酸的钠盐(
。1890年L. Wollf合成并确定了它的结构,1908年池田菊苗从海带的热水提取物中分离出谷氨酸的钠盐(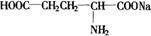 ),它才是具有鲜味的成分,即味精。
),它才是具有鲜味的成分,即味精。
3.计算晶体X的密度;4.X在化工生产中有什么用途;
1.写出X的化学式 和化学名称 ;2.指出阴离子的空间构型 ;
2.写出满足条件的全部X的结构简式,分别命名和计算光学异构体的个数。
第[四]题(9分)离子晶体X是由三种短周期元素组成,三种短周期元素的简单离子的核外电子排布相同,晶胞参数a=780pm,晶胞中阴离子组成立方最密堆积,阳离子(r=102pm)占据全部八面体和四面体空隙。
1.写出X的化学式[ ]和B的结构简式[ ]。
5.试对比评价本离子膜法科技进步的经济、社会效益。
第[三]题(8分)有机物X具有旋光活性,其分子由C、H、O、N 4种元素组成,其中C、H、O的原子个数比是3︰5︰2;工业上可以用A和B以物质的量1︰4通过取代反应制备X;X能与4倍其物质的量的NaOH反应,并能与Ca2+等与大部分金属离子1︰1络合,所得螯合物结构中存在5个五原子环。
4.离子膜法使用的原料要求Ca2+、Mg2+等金属离子的总量控制在0.1ug以下,为什么?
3.传统隔膜法的阴极电解碱液,它所含NaOH的质量分数,为什么只能控制得低些?
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com