
3.为什么在日照强、温度高的海区,表层水碘浓度往往要低一些?
2.在100%硫酸中,I2可被HIO3氧化成I3+,写出配平的离子方程式。
1.单质碘的制备方法之一是在酸性条件下通Cl2于NaI溶液中,指出运用该法时应注意的问题?分析其原因,写出有关反应方程式。
6.汞有一种化合物X,室温下是无气味、白色结晶粉末,不溶解于水,400-500℃时升华,光照能分解,常用做电极材料。X俗名轻粉,可由水银、明矾、食盐等混合炼制,有攻毒杀虫消水肿之功效。
(1)写出X的化学式[ ]和电子式[ ];
(2)写出制备X的化学方程式;(3)从反应体系中分离出X的方法。
第[八]题(16分)化学发展史上,有许多偶然事件引起科学发现的事例,碘的发现也得益于Courtoris对意外现象的注意。碘是人类发现的第二个生物必需微量元素,它以碘化物形式存在于海水、海藻及人体甲状腺中。人类缺碘会引起甲状腺肿大,我国已全面实施加碘盐方案。
5.硫醇的英文名字也叫Mercaptan,来源于拉丁文(Mercurium captans)是捕获汞的意思。医学上常用硫醇类来解除汞中毒,常用一种叫巴尔(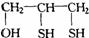 )的作解毒剂。
)的作解毒剂。
(1)乙醇在常温下可以和水混溶,而乙硫醇在常温下的溶解度仅为1.5g,请解释。
(2)反应C2H5OH+NaOH→不能反应;C2H5SH+NaOH→C2H5SNa+H2O。解释其原因。
(3)闻名世界的八大公害之一的[ ],主要就是由重金属汞污染造成的。海洋中的汞是通过生态系统的[ ]进入人体的。人长期食用由于海水、湖水中含有汞离子而中毒的鱼,会吸入汞积聚体内,可引起中毒,其原因是Hg2+能使含有巯基的蛋白酶(酶(SH)2)失去活性,产生汞中毒,临床常用一种解毒剂,如二巯基丙醇(巴尔)可以解毒使蛋白酶恢复活性。试用有关化学反应解释这种现象。
4.重金属引起的污染中以汞的毒性最大。在汞蒸气浓度为10-5kg/m3的空气中停留一两天人就会中毒,因此水银温度计车间必须采取措施防止汞中毒。
(1)万一不慎将汞撒落在工作台上或地面上,将如何处理,用方程式表示;
(2)室内有汞蒸气时应该通风以降低汞的浓度,通风口装在墙上部还是下部,为什么?
(3)液态汞的蒸气压与温度的关系式为lgp=a-b/T a=7.08,b=3190,p的单位为kPa,打碎一根温度计会洒失0.5g Hg,某温度计厂一车间空间为 30m3,若在288K时不慎打破了一根水银温度计,试通过计算判断在该车间工作是否合会导致汞蒸汽中毒。
3.已知下列电对的标准电极电势。ΦøHg2+/Hg22+=0.905V,ΦøHg22+/Hg=0.799,ΦøAg+/Ag=0.800V。
(1)试判断:Ag与Hg(NO3)2溶液能否反应?若能,则写出反应的离子方程式。若不能,则说明理由;
(2)写出过量汞与稀硝酸反应的化学方程式。
1.写出汞原子的核外电子排布式;2.汞用于制造温度计,主要利用了它的什么性质?
1.写出C-F各物质的结构简式;2.写出a、b的反应条件或使用的无机试剂;3.E→F中吡啶(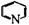 )的作用是什么?
)的作用是什么?
第[七]题(19分)周期表中汞与锌、镉等元素同族,原子序数80,常见的氧化态+2、+1,熔点-38.72℃,沸点357℃,是室温下呈现液态的唯一金属单质。汞是古代就已认知的元素之一,大多数汞来自于辰砂矿,主要用于温度计、气压计、荧光灯和电池。
3.味精中往往会加入食盐,某学生设计如下实验方案测定NaCl含量:取味精样品5.0g,并溶于蒸馏水;加入足量用稀硝酸酸化的硝酸银溶液,使沉淀完全;过滤;用蒸馏水反复洗涤沉淀多次;将沉淀低温烘干、称量;重复操作3次,计算NaCl含量。
另一学生觉得这个实验方案的误差较大,且测定沉淀的质量很不方便。于是他设计了另一个实验方案来测定NaCl的含量。已知AgSCN是难溶于水的沉淀。
请简要写出测定NaCl含量的新方案。
第[六]题(7分)化合物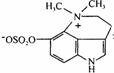 (A)是我国蟾蜍皮中的一种物质,由
(A)是我国蟾蜍皮中的一种物质,由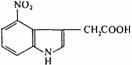 (B)合成该化合物的路线如下:B
(B)合成该化合物的路线如下:B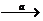 C
C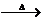 D
D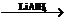 E
E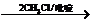 F
F A
A
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com