
1.物理性质:一般都是无色气体;除CH4、SiH4外,均为极性分子,都有刺激性气味;HX、NH3易溶于水,H2S可溶,其余一般不溶。
1.氧化性
(1)与氢气反应
总结:
结论:非金属元素的非金属性越强,其非金属单质的氧化性就越强,就越易与氢气反应;生成的气态氢化物也就越稳定。
(2)与金属反应
2Fe+3Cl2 2FeCl3剧烈反应,大量棕褐色的烟。
2FeCl3剧烈反应,大量棕褐色的烟。
Cu+Cl2 CuCl2剧烈燃烧,生成棕黄色的烟。加少量水,溶液变绿色;再加水,溶液变蓝绿色。
CuCl2剧烈燃烧,生成棕黄色的烟。加少量水,溶液变绿色;再加水,溶液变蓝绿色。
6Fe+4O2  2Fe3O4剧烈燃烧,火星四射,生成黑色固体。
2Fe3O4剧烈燃烧,火星四射,生成黑色固体。
2Cu+O2  2CuO加热变黑。
2CuO加热变黑。
Fe+S  FeS剧烈反应,生成黑色固体。
FeS剧烈反应,生成黑色固体。
2Cu+S  Cu2S铜在硫蒸气中燃烧,有红光。
Cu2S铜在硫蒸气中燃烧,有红光。
结论:非金属单质与变价金属反应,若非金属单质的氧化性较强(如O2、Cl2、Br2等),则金属被氧化成高价态化合物;若非金属单质的氧化性较弱(如I2、S等),则金属被氧化成低价态化合物。
(3)非金属单质间的反应
通常,非金属单质可以与O2或X2反应,生成相应的氧化物或卤化物。O2做氧化剂,除X2外的非金属单质均可被直接氧化;X2做氧化剂,许多非金属单质也可被氧化,较熟悉情况为H2、P等。
原则:非金属性强的氧化非金属性弱的。
(4)非金属间的置换
即:元素同周期,右边的置换左边的;元素同主族;上面的置换下面的。
写化学方程式:
①Cl2+Br-(I-)或Br2+I-;O2+H2S;C+SiO2。
②F2+H2O;Cl2+H2S;CH4+O2(不完全燃烧)。
③O2+HI;Br2+H2S;I2+H2S。
3.溶解性:除F2与水发生置换反应,Cl2、Br2在水中发生自身氧化还原反应(部分)外,可以说非金属单质均难溶于水。
2.晶体类型:原子晶体B、C、Si;分子晶体:除B、C、Si外的其它(常见)非金属单质。
1.常温下状态:气态H2、N2、O2、F2、Cl2(稀有气体除外);液态Br2;其余为固态。
2.除H、He、B外,最外层电子数≥4;且原子半径比同周期的金属元素小。

1.22种非金属元素,有6种是稀有气体;除H外均处于周期表右上方;除第一周期外,每周期非金属元素数目=8-周期序数。
3.以结构为主线,以元素周期律为指导,联系类型、掌握递变。
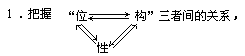
落实存在、性质、制备、用途四要点。
(1)从位置出发,以Cs为例。位置:第六周期,IA族。→结构特点:最外层只有一个电子,原子半径大。→比Na、K更活泼的金属元素,具强的金属性。→应隔绝空气保存;与水反应剧烈,可能发生爆炸;与氧气迅速反应,主要产物肯定不是Cs2O。
(2)从结构出发:已知某元素原子有六个电子层,最外层2个电子→最外层电子数少,电子层数多,应是活泼金属,金属性大于钙→与水剧烈反应;氢氧化物是可溶性强碱;碳酸盐、硫酸盐均不溶于水。
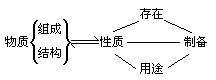 (3)从性质出发:某单质能从水中置换出O2。→非金属性大于氧,应为最活泼的非金属元素F→在周期表的右上角,第二周期ⅦA族→可与绝大多数金属、非金属甚至某些稀有气体直接反应;化合价只有-1价;几乎无法用氧化剂将F-氧化成F2。
(3)从性质出发:某单质能从水中置换出O2。→非金属性大于氧,应为最活泼的非金属元素F→在周期表的右上角,第二周期ⅦA族→可与绝大多数金属、非金属甚至某些稀有气体直接反应;化合价只有-1价;几乎无法用氧化剂将F-氧化成F2。
分析:
归纳:
2.总结规律、串联比较,使知识系统化、网络化。
归纳思维过程:位置→最外层电子数→成键情况→实际价态→化学式
即:位置→结构→性质
21.(本小题满分14分)如图,设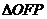 的面积为
的面积为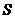 ,已知
,已知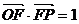 .
.
(1)若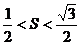 ,求向量
,求向量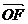 与
与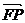 的夹角
的夹角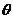 的取值范围;
的取值范围;
(2)若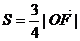 ,且
,且 ,当
,当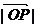 取最小值时,建立适当的直角坐标系,求
取最小值时,建立适当的直角坐标系,求
以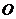 为中心,
为中心,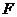 为一个焦点且经过点
为一个焦点且经过点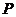 的椭圆方程.
的椭圆方程.

湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com