
6. (1)
|
CO |
CO2 |
HCHO |
|
一个σ键, 一个π键, 一个π配键 |
|
|
|
两个σ键,两个
|
三个σ键,一个π键 |
|
|
|
|
|
|
CH3COOH |
7个σ键,一个
。 |
|
|
|
||
|
(* 实际上CH3COO-中有
:
,而
中OH上的氧 原子采取sp3杂化,所以 的C=O应为定域π键。 |
(2) 根据键级的大小,C-O的键长从小到大的排列为:
CO < CO2 < HCHO < CH3COOH
5.
|
物种 |
IF3 |
ClO3– |
AsCl3(CF3)2 |
SnCl2 |
TeCl4 |
GaF63– |
|
杂化类型 |
sp3d |
sp3 |
sp3d |
sp2 |
sp3d |
sp3d2 |
|
可能几何构型 |
T型 |
三角锥型 |
三角双锥型 |
V型 |
变形四面体 |
正八面体 |
3. ArCl+ OF+ NO+ PS+ SCl+
键级: 1 2 3 3 2
ArCl+键级最小,最不稳定;虽然NO+与PS+的键级都是3,但NO+是2p-2p轨道重叠的π键,而PS+是3p-3p轨道重叠的π键。前者重叠程度大,Eπ大,所以NO+比PS+稳定,即NO+离子最稳定。
|
4. (1) B3N3H6 |
|
||
|
(2) |
|
|
|
(3) 无机苯的三甲基取代物有:
|
|
|
|
|
|
|
(I) |
(Ⅱ) |
(III) |
|
|
|
|
|
|
|
(IV) |
(V) |
(Ⅵ) |
实际上只有四种类型,因为II、IV;IV、VI属于同类型中的几何异构体。这四种类型为(CH3)3B3N3H3、H3B3N3(CH3)3、(CH3)2HB3N3H(CH3)2、H2(CH3)B3N3(CH3)2H。
各基团与H2O的反应:
BCH3 B(OH)2CH3 BH B(OH)3
NH NH3 NCH3 NH2CH3
∴(CH3)3B3N3H3 + 6H2O 3CH3B(OH)2 + 3NH3
H3B3N(CH3)3 + 9H2O 3H3BO3 + 3NH2(CH3) + 3H2
(CH3)2HB3N3H2(CH3) + 7H2O
H3BO3 + 2CH3B(OH)2 + 2NH3 + CH3NH2 + H2
(CH3)H2B3N(CH3)2H + 8H2O
NH3 + 2H3BO3 + CH3B(OH)+ 2NH2CH3+ 2H2
由于这四种类型水解后的产物及其量均有差别,因此根据这些差别可以判断为何种三甲基取代物。
(4) 因为硼氮二元固体聚合物(BN)m与Cn (m = n/2)是等电子体,Cn可以有金刚石型和石墨型,所以(BN)x也具有金刚石型或石墨型。在金刚石型中,B、N采取sp3杂化,无自由电子存在,所以不导电,在石墨型中,虽然B、N都采取sp2杂化,形成层状结构,但未参与杂化的N原子2p轨道上孤电子对占有B原子未参与杂化的2p轨道,成为定域π键,所以也不导电。
|
(5) [B5O9]3–·2H2O [B5O7(OH)4]3– 从阴离子单元的结构式中可以看到阴离子单元的电荷与硼采取sp3杂化的原子个数相等。 |
|
2.
(II)、(V)不稳定,舍去,(I)比(III)、(IV)稳定。
|
|
N(a)-N(b)的键级为5/2~3, N(b)-N(c)的键级为1-3/2, N(c)-N(d)的键级为1-3/2,N(d)-N(e)的键级为5/2-3。 |
N5+有极强的氧化性。应在液态HF中制备N5+。
1. (1) ,(I)的稳定性大于(Ⅱ)。
(2)
第(III)式最稳定。
(3) Cu+ + NO2–+ 2H+ Cu2+ + NO + H2O
(4) 若压强降到原来的2/3,则说明3 mol NO变成2 mol气态物质:
3NO NO2 + N2O,又由于2NO2 N2O4,所以最后的气体总压还要略小于原压的2/3。
9. 在弱碱性溶液中,IO4–被还原为IO3–,根据化学反应方程式,得:
IO4– ~ I2 ~ 2S2O32–
∴ NaIO4% =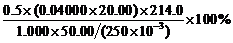 =42.80%
=42.80%
在酸性溶液中,根据化学反应方程式,得:
IO4– ~ 4I2 ~ 8S2O32– IO3– ~ 3I2 ~ 6S2O32–
NaIO3的物质的量
n=(0.04000×50.00–0.5×0.04000×20.00×4)/6=0.04000/6 (mmol)
∴ NaIO3%=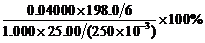 =13.2%
=13.2%
8. (1) 2KMnO4
+ 5H2O2 + 3H2SO4 2MnSO4 + K2SO4 + 5O2
+ 8H2O
2MnSO4 + K2SO4 + 5O2
+ 8H2O
CH3COOOH + 2KI + 2H2SO4 2KHSO4 + CH3COOH + I2 + H2O
2KHSO4 + CH3COOH + I2 + H2O
I2 + 2Na2S2O3 2NaI + Na2S4O6
2NaI + Na2S4O6
(2) 从上述反应方程式看,第一个滴定是用KMnO4(aq)去除制备过氧乙酸过程中多余的H2O2,∴与测定过氧乙酸质量分数无关。
CH3COOOH ~ 2Na2S2O3
∴过氧乙酸质量分数=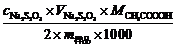
=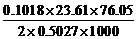 =0.182
=0.182
(3) 由于过氧乙酸不稳定,会发生分解,其量会随时间而变化,∴用三位有效数字来表示实验结果符合客观实际。
(4) CH3COOOH CH3COOH + 1/2O2↑
CH3COOH + 1/2O2↑
(5) 第二个滴定必须在中性或弱酸性溶液中进行。因为:
a. 在碱性溶液中,I2与S2O32–将发生下列反应:
4I2 + S2O32– + 10OH– 8I– + 2SO42– + 5H2O
8I– + 2SO42– + 5H2O
b. 在碱性溶液中,I2会发生歧化:I2 + 6OH– 5I– +IO3–
+ 3H2O
5I– +IO3–
+ 3H2O
c. 在强酸性溶液中,Na2S2O3(aq)会发生分解:
S2O32– + 2H+ S + SO2 + H2O
S + SO2 + H2O
d. 在强酸性溶液中,O2更易于氧化I–离子:4I– + O2 + 4H+ 2I2 + 2H2O
2I2 + 2H2O
7. 对于V1 cm3混合液,消耗V2 cm3 EDTA发生的化学反应有:
Ba2+
+ SO42– BaSO4
BaSO4
Ba2+(过量) + H2Y2– BaY2– + 2H+
BaY2– + 2H+
Mg2+total + H2Y2– MgY2– + 2H+
MgY2– + 2H+
在25.00 cm3蒸馏水中加入V1 cm3混合液,消耗V3 cm3
EDTA所发生的反应为:
Mg2+total + H2Y2– MgY2– + 2H+
MgY2– + 2H+
Ba2+total
+ H2Y2– BaY2– + 2H+
BaY2– + 2H+
在25.00 cm3浸出液中,消耗V4 cm3
EDTA,显然浸出液中含有Mg2+离子,即Mg2+(浸出) + H2Y2– MgY2– + 2H+
MgY2– + 2H+
∴
Mg2+total
 Mg2+(
Mg2+(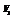 中) + Mg2+(蒸馏水中) + Mg2+(浸出液中)
中) + Mg2+(蒸馏水中) + Mg2+(浸出液中)
∴ 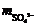 = (V3–V2+V4)×0.0200×96×10–3 = (V3+V4–V2)×1.92×10–3/5g样品
= (V3–V2+V4)×0.0200×96×10–3 = (V3+V4–V2)×1.92×10–3/5g样品
∴ 100 g样品中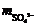 =3.84×10–2(V3
+ V4 – V2)
=3.84×10–2(V3
+ V4 – V2)
6. (NH4)3H4PMo12O42·H2O
+26NaOH 12Na2MoO4+Na2HPO+3NH3+17H2O
12Na2MoO4+Na2HPO+3NH3+17H2O
3NH3+3HCl 3NH4Cl
3NH4Cl
由于26 mol NaOH参与反应,生成3 mol NH3,这3 mol NH3必须用3 mol HCl中和,∴ 1 mol P相当于与23 mol NaOH反应。
∴ 1:23 = x:[0.04×1.026–0.1022×0.0152] ∴x=1.717×10–3 mol
∴P2O5%=(0.5×1.717×10–3×141.94)/0.385=31.7%
5. (1) 此盐为Fe2(C2O4)3·nH2O,该盐,特别是Fe(C2O4)33–具有光敏性质:
2Fe(C2O4)33– 2Fe2+
+ 2CO2 + 5C2O42–
(1) 此盐为Fe2(C2O4)3·nH2O,该盐,特别是Fe(C2O4)33–具有光敏性质:
2Fe(C2O4)33– 2Fe2+
+ 2CO2 + 5C2O42–
(2) 令x为Fe3+的mol数(碘量法测定);y为C2O42–的mol数(用H2O2滴定); z为CO32–的mol数(由释放的气体体积获得)。则:
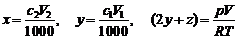 解得:x = 0.020 mol·L–1×0.070 L = 1.4×10–3
mol
y = 0.100 mol·L–1×0.020 L = 2.0×10–3 mol
解得:x = 0.020 mol·L–1×0.070 L = 1.4×10–3
mol
y = 0.100 mol·L–1×0.020 L = 2.0×10–3 mol
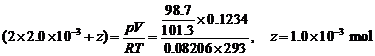
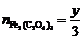 =6.67×10–4 mol,
=6.67×10–4 mol, 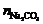 =1.0×10–3 mol
=1.0×10–3 mol
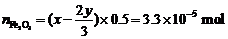
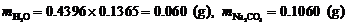 ∴
∴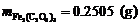 ,
, ,
,
总质量 = 0.2505+0.0054+0.060+0.1060=0.4219 (g), 杂质的质量 = 0.4396 – 0.4219 = 0.0177 (g)。
(a)水合盐的化学式为:Fe2(C2O4)3·nH2O
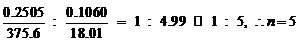 ,
,
化学式为Fe2(C2O4)3·5H2O。
(b)无水化合物的百分含量为
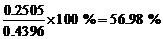
水合盐的百分含量为 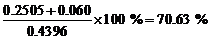
(c)氧化物的百分含量为
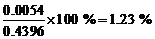
(3) Fe3+ + 3CO32– + 3H2O
 Fe(OH)3
+ 3HCO3–
Fe(OH)3
+ 3HCO3–
Fe(OH)3
+ 3C2O42–
 Fe(C2O4)33–+
3OH–
Fe(C2O4)33–+
3OH–
C2O42–
+ Ba2+  Ba C2O4
H2C2O4
+ H2SO4(浓)
Ba C2O4
H2C2O4
+ H2SO4(浓)  CO + CO2
+ H2SO4(稀) + H2O
CO + CO2
+ H2SO4(稀) + H2O
CO32–
+ 2H+  CO2
+ H2O
CO2
+ H2O
2Fe3+
+ 2I– 2Fe2+ + I2
2Fe2+ + I2
I2 +
2S2O32– 2I– + S4O62–
2I– + S4O62–
C2O42–
+ H2O2 + 2H+  2CO2↑
+ 2H2O
2CO2↑
+ 2H2O
(4) 杂质的百分含量为 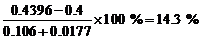
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com