
4. 加入KMnO4后,发生下列反应:
5C2O42– + 2MnO4– + 16H+ = 10CO2 + 2Mn2+ + 8H2O 5NO2– + 2MnO4– + 6H+ = 5NO3– + 2Mn2+ + 3H2O
5AsO33– + 2MnO4– + 6H+ = 5AsO43– + 2Mn2+ + 3H2O 加入KI后,发生下列反应:2NO2– + 2I– + 4H+=I2 + 2NO + 2H2O 在碳酸氢钠介质中,发生下列反应: AsO33– + I2 + 2OH– = AsO43– + 2I– + H2O
肼与碘发生如下反应:(N2H4·H2SO4相当于N2H4参加反应) N2H4+ 2I2 + 4OH– =N2 + 4I– + 4 H2O
这样,我们可以写出三个联立方程式:
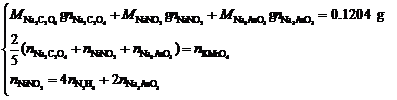
用下法计算KMnO4的物质的量n:
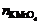 =0.02×25×10–3–
=0.02×25×10–3–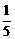 ×0.02×5×10–3 =0.48×10–3 mol
×0.02×5×10–3 =0.48×10–3 mol
N2H4的物质的量=0.02×25×10–3=0.1×10–3
mol=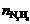 ∴
∴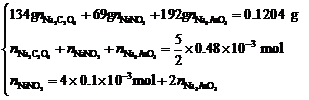
解得: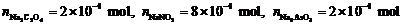
故混合物的组成为: Na2C2O4: 22.26 %,NaNO2: 45.85 %,Na3AsO3: 31.89%。
3. 求反应中Cl–离子的物质的量和质量:
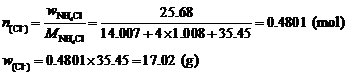 求NH3中N的物质的量和质量:
求NH3中N的物质的量和质量:
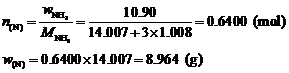 求AyNz中N的物质的量,根据物料守恒,
AyNz中N的物质的量=0.6400 –
0.4801=0.1599 (mol)
(∵在NH4Cl中
求AyNz中N的物质的量,根据物料守恒,
AyNz中N的物质的量=0.6400 –
0.4801=0.1599 (mol)
(∵在NH4Cl中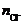 =nN),∴N的质量=0.1599×14.007=2.240 (g)
求AwCln中A的质量,AyNz中A的质量:
w(AwCln中的A) = 24.71–w(Cl–) =
24.71–17.02 = 7.69 (g)
w(AyNz中的A) = 7.69–2.57 = 5.12 (g)
由此可见,在生成物A中的质量分配比为2.57 : 5.12 = 1 : 2,
N的质量分配比=(8.964–2.240)
: 2.240 = 3 : 1。
对于AwCln而言,Cl–重17.02 g,A重7.69 g,
=nN),∴N的质量=0.1599×14.007=2.240 (g)
求AwCln中A的质量,AyNz中A的质量:
w(AwCln中的A) = 24.71–w(Cl–) =
24.71–17.02 = 7.69 (g)
w(AyNz中的A) = 7.69–2.57 = 5.12 (g)
由此可见,在生成物A中的质量分配比为2.57 : 5.12 = 1 : 2,
N的质量分配比=(8.964–2.240)
: 2.240 = 3 : 1。
对于AwCln而言,Cl–重17.02 g,A重7.69 g,
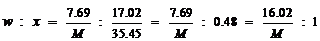
∵w、x为正整数,∴M=16,w : x=1 : 1,不符合性质。 M=32,w : x=1 : 2。
(1) ∴该元素应为硫元素。AwCln为SCl2,A为S,AyNz=SyNz
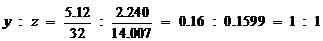 ,∴实验式为SN。
,∴实验式为SN。
(2) 反应方程为:3SCl2 + 8NH3=6NH4Cl + S + S2N2或 6SCl2 + 16NH3=12NH4Cl + 2S + S4N4 或者(S2N2)x具有金属导电性,在低温有超导性,∴应为S2N2。
(3) 2SCl2 + 6NH3–2e → 4NH4Cl + 2H+ + S2N2 SCl2 + 2e → 2Cl– + S
2. M2O(5–x)与Ce4+的反应方程式为:
M2O(5–x) + 2 xCe4+ + xH2O = M2O5 + 2 xCe3+ + 2xH+
消耗氧化物的mol数为n,则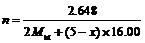 Ce(ClO4)4的mol数为2nx=4.13×10–3
mol,∴n=
Ce(ClO4)4的mol数为2nx=4.13×10–3
mol,∴n=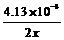 ∴
∴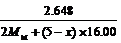 =
=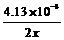 ,MM=649x– 40.0
∵x<0.2,则MM<649×0.2–40.0=89.8
由题意知M为第五副族钒,∴MV=50.9<89.8,则x=
,MM=649x– 40.0
∵x<0.2,则MM<649×0.2–40.0=89.8
由题意知M为第五副族钒,∴MV=50.9<89.8,则x=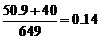 该氧化物为V2O4.86。
该氧化物为V2O4.86。
1. (1)设一元有机羧酸为CnH2n+1COOH,其酸根离子为CnH2n+1COO–
阳极反应:2 CnH2n+1COO–
– 2e → C2nH4n+2
+ 2CO2 ①
C2nH4n+2 在过量的O2中燃烧得:
C2nH4n+2 + (3n + 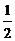 ) O2 = 2nCO2 + (2n+1)H2O
②
从①、②式中可知:总共放出CO2为(2n+2)mol。
由于Ba(OH)2增重的是CO2,∴ CO2 mol数=
) O2 = 2nCO2 + (2n+1)H2O
②
从①、②式中可知:总共放出CO2为(2n+2)mol。
由于Ba(OH)2增重的是CO2,∴ CO2 mol数=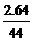 =0.06 mol
=0.06 mol
|
∴ CnH2n+1COO– |
CO2 |
|
2 |
2n
+ 2 |
|
x |
0.06 |
2:x = (2x + 2) :0.06 解得x=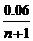 |
由于2 mol CnH2n+1COO– 电解需2×96500库仑电量,
x mol CnH2n+1COO– 电解需1929.86库仑电量,
∴2 : x = 2×96500:1929.86,解得x=0.02
∴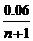 =0.02,解得n=2,C2H5COOH
该有机酸为丙酸,2 C2H5COO– – 2e
→ C4H10
+ 2CO2
=0.02,解得n=2,C2H5COOH
该有机酸为丙酸,2 C2H5COO– – 2e
→ C4H10
+ 2CO2
(2)由于反应得0.02 mol C2H5COO–,∴ C2H5COO–只剩下0.05×0.8–0.02=0.02 mol
[H+]=10–4.57=2.69×10–5 mol·dm–3
[C2H5COO–]=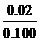 =0.2 mol·dm–3
[C2H5COOH]=
=0.2 mol·dm–3
[C2H5COOH]=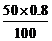 =0.4 mol·dm–3
∴Ka=
=0.4 mol·dm–3
∴Ka=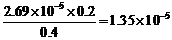
8. 设某溶液中含有VO2+ x mol,MnO4– y mol,Cr2O72– z mol,
则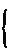
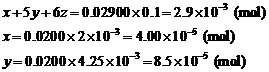
∴z = 4.058×10–4 (mol)
∴ 溶液中含V: 4.00×10–5×50.94×1000=2.04 mg
Mn: 8.5×10–5×54.94×1000=4.67 mg
Cr: 4.058×10–4×2×52.00×1000=42.2 mg
(B)
7. (1) 2Na2S + 2O2 + H2O Na2S2O3
+ 2NaOH
Na2S2O3
+ 2NaOH
∴ 4Na2S ~ 2Na2S2O3 ~ I2
Na2S
+ I2 2NaI + S Na2S ~ I2
2NaI + S Na2S ~ I2
设被氧化的样品中含有x mol Na2S,y mol Na2S2O3和2y mol NaOH。
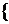
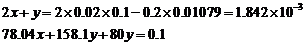
解得x = 8.504×10–4 (mol)
y = 1.413×10–4 (mol)
∴被氧化样品的百分数=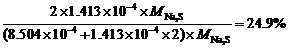
(2)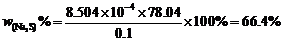
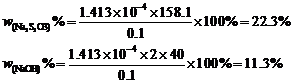
6. BrO3–
+ 5Br– + 6H+ 3Br2 + 3H2O
3Br2 + 3H2O
 |
+
3Br2 |
 |
+3HBr |
I2 + 2S2O32– 2I– +
S4O62–
2I– +
S4O62–
|
∴BrO3– ~ 3Br2 |
|
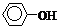 |
~
3Br2 |
|
2S2O32– ~ I2 ~ Br2 |
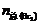 = 3×0.020×0.125=7.500×10–3 (mol)
= 3×0.020×0.125=7.500×10–3 (mol)
与KI反应的Br2为: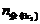 = 0.1050 ×0.02×0.5 = 1.050×10–3 (mol)
= 0.1050 ×0.02×0.5 = 1.050×10–3 (mol)
∴ n苯酚= (7.500×10–3 – 1.050×10–3)/3 = 2.15×10–3 (mol)
w(苯酚)% = (2.15×10–3×94.11/0.6000)×100% = 33.7%
0.1×0.5=0.05mol 4.95
∴ 2:(2Mx-65.39n) = 0.05:4.95 Mx = 99 + (65.39n/2)
n = 0,Mx = 99,Tc不合题意;n = 1, Mx =131.70,Xe不合题意;
n = 2,Mx = 164.39,Ho不合题意;n = 3, Mx =197.09,Au合题意;
∴X为Au,Y为AuCl3,Z为HAuCl4∙mH2O
MAu/(1+MAu+4×35.45+18m)=0.5,解得m=3
∴ Z为HAuCl4∙3H2O。
5. 设X与Cl2反应,产物中X的氧化数为+n,则
X + nCl2  2XCln 则Y的分子式为XCln
2XCln 则Y的分子式为XCln
2XCln + nZn 2X + nZnCl2
则X的原子量为Mx。
2X + nZnCl2
则X的原子量为Mx。
Δm
2 mol 2Mx-65.39n
4. 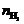 =2.00/22.4=0.0893 (mol),
=2.00/22.4=0.0893 (mol),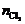 =5.00/70.9=0.0705 (mol)
=5.00/70.9=0.0705 (mol)
∵ Cl2完全反应,∴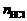 =0.0705×2=0.141 (mol)
=0.0705×2=0.141 (mol)
nNaOH=(80×1.10×9.00%)/40.0=0.198 (mol)
∴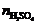 =(0.198-0.141)/2=0.0285 (mol)
=(0.198-0.141)/2=0.0285 (mol)
需要加入的硫酸体积V=(0.0285/0.1)×1000=285 (mL)
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com