
3. (1) 该元素的原子量为(55.59×2)/1.01-16.00 × 2 = 78.08,该元素为Se。
(2) 3BO2 + Cr2O72– + 2H+ 3BO42– + 2Cr3+ + H2O
3BO42– + 2Cr3+ + H2O
∴ 3BO2 - Cr2O72– - 6Fe2+
∴ B元素原子量为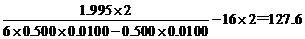
故B元素为Te。
(3) 第一步量取V0 mL混合液,加入c1 mol∙dm–3的KMnO4标准溶液V1 mL(过量),充分反应后,以c2 mol∙dm–3的Na2C2O4标准溶液滴定至终点,耗去Na2C2O4标准溶液的体积为V2 mL;
第二步重量取V mL混合液,加入c3 mol∙dm–3的K2Cr2O7标准溶液V3 mL(过量),充分反应后,以c2 mol∙dm–3的Na2C2O4标准溶液滴定至终点,耗去Na2C2O4标准溶液的体积为V4 mL。
(4)
2. (1) 含硫产物为Na2SO4,含铬产物为Cr(OH)3或NaCrO2。
(2) 反应物中含的硫的物质的量=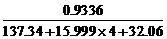
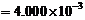 mol (以BaSO4形式沉淀)
mol (以BaSO4形式沉淀)
根据S原子守恒得:[SO32–] + 2[S2O32–] = 4.000×10–3/1.000 = 4.000×10–3
根据电子守恒得:2[SO32–] + 8[S2O32–] = 0.0500×0.08×3
解得:[SO32–] = 0.002 mol∙dm–3 [S2O32–] = 0.001 mol∙dm–3
(A)
1. (1) 2Mn2+ + O2 + 4OH– 2MnO(OH)2
MnO(OH)2 + 2I– + 4H+
2MnO(OH)2
MnO(OH)2 + 2I– + 4H+ Mn2+
+ I2 + 3H2O
I2 + 2S2O32–
Mn2+
+ I2 + 3H2O
I2 + 2S2O32– 2I– +
S4O62–
2I– +
S4O62–
(2) KIO3 - 3I2 - 6S2O32–
 mol∙dm–3
mol∙dm–3
(3) O2 - 2I2 - 4S2O32–
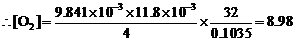 g∙dm–3
g∙dm–3
(4) 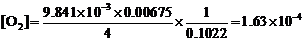 mol∙dm–3
mol∙dm–3
(5) 说明水样中有好(耗)氧性物质,新鲜水样放置后,溶解氧会不断减小。
12. (1)
(2) 将K2PtCl4转化为A的目的是为了得到目标产物E,这是由于I-的反位效应小于Cl-的反位效应,PtCl42-的取代反应发生在平面四方的邻位上,PtI42-的取代反应发生在平面四方的对位上。
(3) 由于AgI的溶解度大大小于Ag2CO3,加入Ag2CO3后,可以使D中的配体I-脱离中心体而利于丙二酸根离子的配位。
|
13. (1) |
|
(2) 丙酮的作用是降低B在水中的溶解度。
(3) D的相对分子质量为491.5,设n为D中游离氯离子数,x为D中游离的氯离子含量,则:35.5n/491.5=x,当n=1时,x=7.22%,与实验值7.18%相近,表明D的外界有一个游离氯离子。
|
14. |
Pt(NH3)2Cl2: |
|
|
|
|
|
15. (1) A是反磁性配合物,∴Ni2+采取dsp2杂化,则NiBr2X2为平面四方。 |
|
B的μ=3.20 B.M.,∴Ni2+采取sp3杂化,NiBr2X2为四面体。 |
(2) 由于△sq≥△t,∴曲线I属于配合物A,(∵它有最小的吸收波长390 nm);曲线II属于配合物B,(它的最小吸收波长为485 nm)。
(3) 由于可见光范围为400 nm - 700 nm,A的510 nm,B的485 nm、700 nm吸收峰都与A、B的颜色相对应。
(4) B在氯仿中有一部分转化成A,所以磁矩减小,得到微带红色的绿色溶液。
(5) A为黑色。因为A吸收光的波长中有510 nm,它把该单色可见光吸收后,当然显黑色。
|
16. (1) |
|
L中的配位原子为O原子,中心金属原子配位数为6。 |
|
|
(2) |
该配合物为八面体。 |
|
|
(3) 由于反式-Ru( )2(SCN)2无光学异构体,所以只考虑顺式-Ru( )2(SCN)2有旋光活性的键合异构体。
(4) 半导体电极表面发生的电极反应式为:4h+ + 2H2O O2 + 4H+
对电极表面发生的电极反应式为:4H++ 4e- 2H2
总反应方程式为:2H2O O2 + 2H2
(5) 因纳米晶TiO2膜几乎不吸收可见光(Ti4+电子构型为3d0),而太阳光能量密度最大的波长在560 nm附近,故必须添加能吸收可见区该波长范围光能的光敏剂,才有可能充分利用太阳光的能量。
(6) 由于自由Ti4+离子的基态价电子组态为(3d0),∴TiO2既不能实现d-d电子跃迁,TiO2是白色,也不可能在可见光范围内发生电荷跃迁(Ti4+←O2-),因此,不吸收可见光,以至于呈白光。再由题意可知:配合物Ru( )2(SCN)2吸收绿色和红色光,由互补色原理推测出:该配合物应当显橙色。
(7) 可用于环保型汽车发动机。该光电化学电池装置所得到产物氢气,属于清洁能源,可通过氢气燃烧产生的热能用于汽车发动机,亦可经由氢燃料电池产生的电能用于汽车发动机。
11. (1) A:[Co(NH3)4CO3]Cl
B:C、D混合物
C:顺式-[Co(NH3)4Cl2]Cl
D:反式-[Co(NH3)4Cl2]Cl
(2) 4CoCO3 + O2 + 4NH4Cl 4[Co(NH3)4CO3]Cl + H2O
[Co(NH3)4CO3]Cl + 2HCl cis- [Co(NH3)4Cl2]Cl + CO2 + H2O
[Co(NH3)4CO3]Cl + 2HCl trans- [Co(NH3)4Cl2]Cl + CO2 + H2O
(3) C中配离子的极性大于D中配离子的极性,因为结构对称的配离子是D,而结构不对称的配离子是C。
(4) 用少量水洗涤的目的是把D洗掉,因为D溶于冷水,当C在浓盐酸中加热,可分离出一种绿色化合物D,这显然是浓盐酸的作用。
(5) C和D属于几何(顺-反)异构体,所以C与D之间的转化属于顺反异构转化反应。
(6) 从提示来看:a. 紫色-[CoCl2(en)2]+可以拆分成左旋与右旋异构体,所以紫色化合物属于顺式结构,因为紫色物种无对称面,有光学异构体;b. 在阳离子交换色谱柱上先淋洗下来的是少量绿色溶液,这说明绿色物种是反式-[Co(NH3)4Cl2]+,因为反式结构无极性,所以在柱子上吸附能力弱,先被淋洗下来。从a、b提示中我们可以判断C是cis- [Co(NH3)4Cl2]+,D是trans- [Co(NH3)4Cl2]+。
10. (1) 异构体数目为6(1):
|
(2) 3种: |
|
8. 解析:配合物A有顺磁性,由于Ni3+的价电子构型为3d7,有单电子,必然有顺磁性,有极性,说明该分子中的化学键不能抵消,即不是对称分子,但难溶于水,易溶于苯且苯溶液不导电,这说明A无外界简单离子存在,都是内界,即[Ni(PEt3)2Br3]。
上述每种几何构型都有对称面,故不存在对映体。
|
9. |
|
若C为面式-RuCl3(H2O)3,由于三个Cl-离子在等边三角形上,完全处于等价位置,失去任何一个Cl-离子,都得到顺式-RuCl2(H2O)4+,所以A一定是顺式-RuCl2(H2O)4+;对于D而言,由于Cl-离子的反位效应大于H2O,所以H2O取代Cl-离子时,先要取代Cl-离子对位的那个Cl-离子,故也得到顺式-RuCl2(H2O)4+。
6. (1) Fe(CO)5、Cr(CO)6 (2) Cr(NO)4 (5)
(3) 由于Mn(0)和Co(0)的价电子为奇数,所以不能形成单核
中性羰基化合物,只能形成有金属键的双核中性羰基化
合物:Mn2(CO)10,Co2(CO)8。
(4) V(CO)6是顺磁性。∵它属于17电子构型,而(1)、(2)问
中提出的化合物都是反磁性的,∵它们都属于18电子构型。
|
7. |
|
5. (1)
(2) 对于[Fe4S3(NO)7]-,S的氧化数为-2,
NO的氧化数为+1(NO为直线型配
位),令铁的平均氧化数为x,
4x-2×3+1×7=-1,x=-1/2,即
铁的平均氧化数为-1/2。
(3) 由于Fe(B)、Fe(C)、Fe(D)的周围环境相同,它们的氧化数理应相同,而Fe(A)有另外的氧化数,氧化数可能值为:Fe(A)=-2,Fe(B)=Fe(C)=Fe(D)=0,或者Fe(A)=+1,Fe(B)=Fe(C)=Fe(D)= -1。当第二组氧化数代入后,Fe(B)、Fe(C)、Fe(D)周围的电荷为零,只有Fe(A)周围电荷为离子团电荷-1,所以更为合理。对于Fe(0)而言,若采取sp3杂化来接受配位原子的孤电子对,则价电子排布应从3d64s2重排成3d84s0。对于+1氧化态的Fe(A),为3d7;对于Fe(B)、Fe(C)、Fe(D)而言,由于是-1氧化态,应为3d9。
|
(4) (I) |
|
(II) 每个铁的氧化数为-1
(III) n = 0,加到S原子上的一定是CH3+。∵硫原子氧化态为-2,已是8电子构型,即为Lewis碱,只有与CH3+ Lewis酸加合。
2. (1) Cr(CO)5 不符合 (2) Mn(CO)6 不符合 (3) (ph3P)2Fe(CO)3 符合
(4) [Fe(CN)6]4– 符合 (5) [Co(NH3)5Cl]+ 不符合
|
3. (1) |
|
(2) |
|
(3) |
|
(4) |
|
(5) |
|
(6) |
|
4. A: |
|
B: |
|
C: |
|
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com