
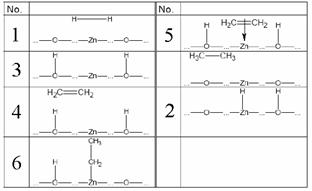
1. (1) [Cu(NH3)4]SO4 (2) Ag(CN)2– (3) [Al(H2O)4(OH)2]–
(4) K[PtCl3(C2H4)] (5) NH4[Cr(NH3)2(SCN)4] (6) cis–Pt(NH3)2Cl2
11.(1) x = 1,y = -1,z = 1
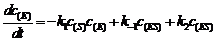 (2)
(2)
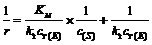
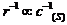 (3) 图中表示
,
(3) 图中表示
,
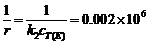
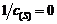 当 时,截距为0.002
当 时,截距为0.002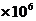 ,
,
∴
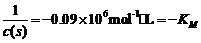
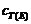 ∵ = 10-9
mol·L-1,∴ k2 =
50000 min-1
∵ = 10-9
mol·L-1,∴ k2 =
50000 min-1
当1/r = 0时, ,
∴
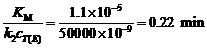
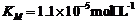 图中直线斜率=
图中直线斜率=
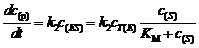 酶反应的速率方程为:
酶反应的速率方程为:
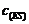 =
=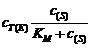 =
=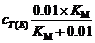
= 10-9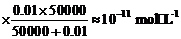
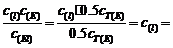 (4) K =
9.5
(4) K =
9.5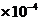
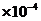
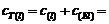 (
(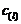 表示平衡时抑制物浓度)
表示平衡时抑制物浓度)
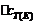
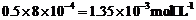
 ∴ 9.5 + 0.5
∴ 9.5 + 0.5
= 9.5 +
(5) ①正确 (∵抑制物降低游离酶的浓度,因此降低酶形成速率,低的ES浓度导致慢反应速率)。
 ②错误 (对于c(S) → ,最大速率时抑制物浓度可以忽略)。
②错误 (对于c(S) → ,最大速率时抑制物浓度可以忽略)。
③错误 (∵抑制物降低游离酶浓度,促进ES离解成E和S)。
④错误 (活化能取决于速率常数,与浓度无关)。
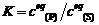
 (6) 酶为催化剂,所以净反应为S
P
(6) 酶为催化剂,所以净反应为S
P
①正确 [∵ ]
②错误 [∵K不取决于酶的浓度]
③正确 [∵K是正逆反应速率常数之比]
10.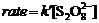
 (1)
(1)
(2) ④是正确的,因为被吸附的中间物的氢化是最慢的反应。
(3) 下面四种答案都可以接受:
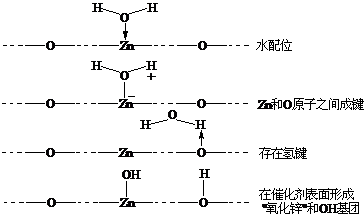 (4)
(4)
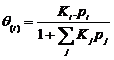 (5)
(由质量作用定律推得)
(5)
(由质量作用定律推得)
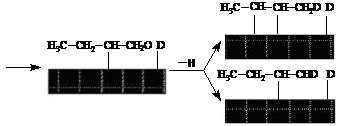
9. (1)
(1)
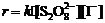 (2) 当[I-]不变时,
(2) 当[I-]不变时,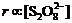 ,当
,当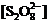 不变时,
不变时,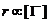 ,
,
∴
(3) 总反应级数= 1 + 1 = 2; 对S2O82-,反应级数为1;对I-反应级数为1。
 (4)
(4) 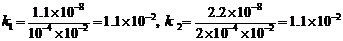
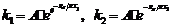 (5) 由阿累尼乌斯公式得:
(5) 由阿累尼乌斯公式得:
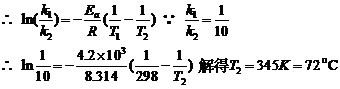
 (6) I2 + 2S2O32-
2I- + S4O62-
(6) I2 + 2S2O32-
2I- + S4O62-
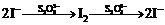 (7) 由于I2与S2O32-离子的反应非常快,可视I-离子浓度不再变化,显然
,即消耗I-离子后立即又形成I-离子,令k[I-] = k¢,则
。
(7) 由于I2与S2O32-离子的反应非常快,可视I-离子浓度不再变化,显然
,即消耗I-离子后立即又形成I-离子,令k[I-] = k¢,则
。
8.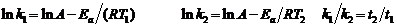

∴
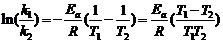
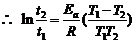
 解得
解得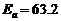 kJ·mol-1
kJ·mol-1
7. (1) ∴ = = 0.132 y−1
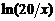
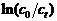 = kt ∴ = 0.132×10 解得x = 5.34 (mg)
= kt ∴ = 0.132×10 解得x = 5.34 (mg)
6.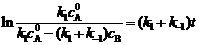 (1) 必须求出当cB = 0.1 mmol·dm-3时分别在298K和308K时的反应速率,看题给的反应速率0.13 mmol·dm-3·min-1是否在这两个温度范围内。先要求得298K、308K时的k1和k-1。
(1) 必须求出当cB = 0.1 mmol·dm-3时分别在298K和308K时的反应速率,看题给的反应速率0.13 mmol·dm-3·min-1是否在这两个温度范围内。先要求得298K、308K时的k1和k-1。
据题条件得: (1)
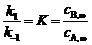
 又已知:
,足够长时,反应总达到平衡。( 和
又已知:
,足够长时,反应总达到平衡。( 和
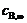
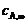 为平衡时B、A浓度。)
(2)
为平衡时B、A浓度。)
(2)
将(2)式代入(1)式,得:
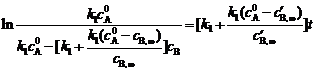
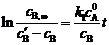
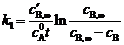 整理得
,∴
整理得
,∴
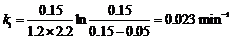
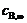 在298K时, = 1.2 mmol·dm-3, = 0.15 mmol·dm-3, = 0.05 mmol·dm-3,t = 2.2 min,代入上式中,得:
在298K时, = 1.2 mmol·dm-3, = 0.15 mmol·dm-3, = 0.05 mmol·dm-3,t = 2.2 min,代入上式中,得:
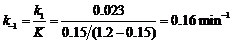
同理:在308 K,
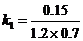
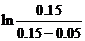 = 0.072
= 0.072 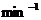
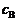
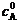
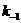 =
=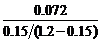 = 0.50
= 0.50 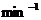
当 = 2.1 mmol·dm-3时,要达到 = 0.1 mmol·dm-3时的反应速率为:
298K 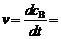
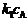 -
-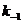
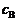 =
=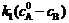 -
-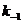
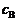
= 0.023×2.1-(0.023-0.16)×0.1= 0.030 mol·dm-3·min-1
308K
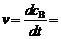
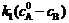 -
-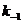
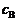
= 0.072 × 2.0 - 0.50 × 0.1 = 0.094 mmol·dm-3·min-1
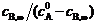 计算结果表明,实验要求的反应速率0.13 mmol·dm-3·min-1,不在298-308 K的反应速率范围内,因此合适的温度不能在298K-308K范围内选择。
计算结果表明,实验要求的反应速率0.13 mmol·dm-3·min-1,不在298-308 K的反应速率范围内,因此合适的温度不能在298K-308K范围内选择。
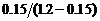 (2) K(298K)
= =
= 0.14
(2) K(298K)
= =
= 0.14
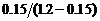 K(308K) =
= 0.14
K(308K) =
= 0.14


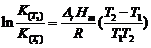 由
得:DrH m = 0
由
得:DrH m = 0


 由DrG m(T) =
DrH m(T) – T×DrS m(T) 得:
由DrG m(T) =
DrH m(T) – T×DrS m(T) 得:
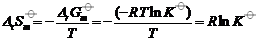


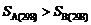

 ∴DrS m = 8.314×ln0.14 =-16.35 J·mol–1·K–1,这说明DrS m < 0,∴
,
∴DrS m = 8.314×ln0.14 =-16.35 J·mol–1·K–1,这说明DrS m < 0,∴
,
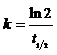

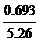 ∴A为顺式,B为反式(对称性大,S相对小)。
∴A为顺式,B为反式(对称性大,S相对小)。
5.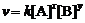 (1) 由反应方程式A + 2B == 2C + 2D可知,[A]与[B]消耗的关系式为[A]=[B]/2,则速率方程
可以表示成
(1) 由反应方程式A + 2B == 2C + 2D可知,[A]与[B]消耗的关系式为[A]=[B]/2,则速率方程
可以表示成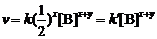 ,其中
,其中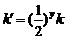
当[B]0 = 0.020时,t1/2 = 90 h
当[B]0¢ = 0.010时,t1/2¢ = 217 – 90 = 127 h
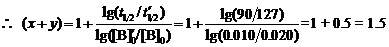
∴此反应的总反应级数为1.5级。
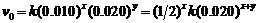 (2) 当[A]0 = 0.010 mol·dm-3,[B]0 = 0.020 mol·dm-3时,初速度为
(2) 当[A]0 = 0.010 mol·dm-3,[B]0 = 0.020 mol·dm-3时,初速度为
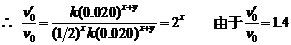 当[A]0¢ = [B]0¢ = 0.020 mol·dm-3时,v0¢ = k(0.020)x+y
当[A]0¢ = [B]0¢ = 0.020 mol·dm-3时,v0¢ = k(0.020)x+y
∴ 2x = 1.4,x = 1/2,∴ y =1.5 - (1/2) = 1
∴ A的反应级数为0.5,B的反应级数为1。
(3) 由反应速率方程可知:
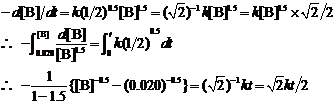
∴ 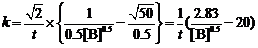
当t = 90 h = 324000 s时,[B] = 0.0100 mol·L-1
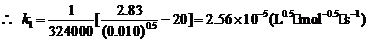
当t = 217 h = 781200 s时,[B] = 0.0050 mol·L-1
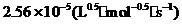
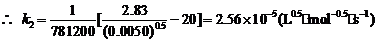 ∴反应速率常数k = (k1 + k2)/2 =
∴反应速率常数k = (k1 + k2)/2 =
4. (1) 根据题意N2O5(s) 2NO2(g) + 1/2O2(g)为一级反应
(1) 根据题意N2O5(s) 2NO2(g) + 1/2O2(g)为一级反应
∴ ln(c0/c) = kt
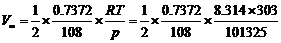
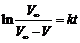 若以体积来表示
,
若以体积来表示
,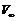 为0.7372 g N2O5 (s)完全分解所产生的O2体积:
为0.7372 g N2O5 (s)完全分解所产生的O2体积:
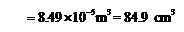
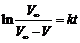
 由
得:
由
得:
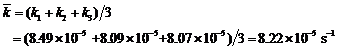
∴
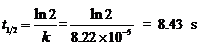
(2) 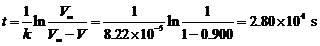
(3) 2400秒内要收集60.00 cm3 O2,则需要调节反应温度。在调节温度下,速率常数k为:
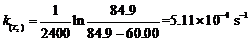
根据Arrhenius公式:
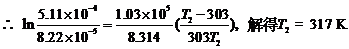 ln
ln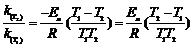
即在317 K温度下进行N2O5的分解实验,可在2400秒内收集60.0 mL O2。
3.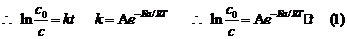 由于漆包线表面漆膜发生的热降解作用服从一级反应,
由于漆包线表面漆膜发生的热降解作用服从一级反应,
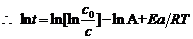
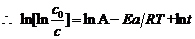 {(1)式两边取对数而得}
{(1)式两边取对数而得}
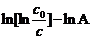 漆包线失效时,即漆膜失效,从已知条件知,在各实验条件下,漆膜重量均减少39.0%。所以我们可以把上式中(
)在漆包线失效时看作恒重,即lnt = B
+ Ea/RT
漆包线失效时,即漆膜失效,从已知条件知,在各实验条件下,漆膜重量均减少39.0%。所以我们可以把上式中(
)在漆包线失效时看作恒重,即lnt = B
+ Ea/RT
T (K) 393.0 411.0 453.0
t (h) 20000 5000 307.0
(1) (2) (3)
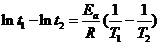 ,
,
∴由(1)(2)得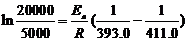 ,Ea = 103.4 kJ·mol-1
,Ea = 103.4 kJ·mol-1
由(2)(3)得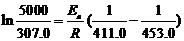 ,Ea = 102.8 kJ·mol-1
,Ea = 102.8 kJ·mol-1
由(1)(3)得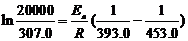 ,Ea = 103.0 kJ·mol-1
,Ea = 103.0 kJ·mol-1
∴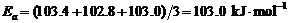
再求B。lnt = B + Ea/RT
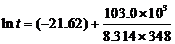
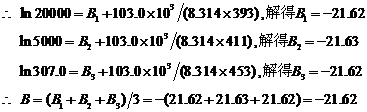
当T = 348.0 K时, ,
解得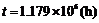
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com