
31.(卢湾二) 辉铜矿的主要成分为Cu2S,是提取铜的主要原料。Cu2S在1200℃高温下被氧气氧化而发生如下反应: 2Cu2S + 3 O2 → 2Cu2O + 2
SO2 2
Cu2O + Cu2S → 6Cu + SO2
不考虑其它反应,(工业所用的氧气来自于空气的分离,设空气中N2、O2的体积分数分别为0.80和0.20),试完成下列各题:
(1)1.0mol Cu2S氧化为Cu2O,需要标准状况下的空气的体积为 L。
(2)1.0mol Cu2S 与126升标准状况下空气反应,可生成Cu的物质的量 mol。
(3)1.0mol Cu2S 与一定量空气反应,经分析得到固体混合物的含铜元素的质量分数为0.923,将固体物质的可能组成及相应的物质的量之比,填入下表(可不填满或补充)
|
物质的组成 |
相应的物质的量之比 |
|
|
|
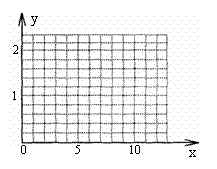 (4)1.0mol
Cu2S 与x mol空气反应,写出生成的Cu的物质的量(y)与x之间的函数关系,并在下图中画出y和x关系的图形。
(4)1.0mol
Cu2S 与x mol空气反应,写出生成的Cu的物质的量(y)与x之间的函数关系,并在下图中画出y和x关系的图形。
31.(10分)(1)2.4g(2)O2,0.168L,0.6mol/L(3)3.48g或2.32g
(4)2.4g≤x<5.64g, y=4; 2.16g≤x≤2.4g, 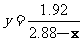
31.(闵行一)硝酸铜受热易分解:2Cu(NO3)2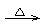 2CuO+4NO2↑+O2↑,当温度达到800℃时,CuO开始分解:4CuO
2CuO+4NO2↑+O2↑,当温度达到800℃时,CuO开始分解:4CuO 2Cu2O+ O2↑,至1000℃以上,CuO完全分解(加热过程中忽略2NO2⇌N2O4,2NO2→2NO+O2等反应)。
2Cu2O+ O2↑,至1000℃以上,CuO完全分解(加热过程中忽略2NO2⇌N2O4,2NO2→2NO+O2等反应)。
现取5.64gCu(NO3)2无水晶体,在一定温度下使其分解,将生成的气体及时导出并用足量的NaOH溶液充分吸收。
(1)若该质量的无水硝酸铜经加热完全分解,其中的铜元素全部转化为氧化铜,则氧化铜的质量是_____________。
(2)若该质量的无水硝酸铜完全分解,铜元素全部转化为氧化亚铜,反应过程中生成的气体被足量的NaOH溶液充分吸收后,还有多余的气体,并得到100mL的溶液,则多余的气体是______________(填分子式),其体积(标准状况)是_____________L,溶液中NO3-的物质的量浓度是____________________________。
(3)若该质量的无水硝酸铜分解后的残留固体中含有1.60g CuO,则残留固体的质量可能是______。
(4)设该质量的无水硝酸铜在分解过程中,得到的残留固体质量为xg,生成的气体中NO2和O2的体积比为y,求y与x的关系式。
31.(1)Fe3O4+C→3FeO+CO 28(2)44.8 11(3)Og<mc≤48g(4)36Xg≥m≥7Xg (5)略
31.(十四校一)把四氧化三铁现焦炭混合后隔绝空气加热,生成物分别可能为FeO、Fe,CO、CO2。
(1)写出四氧化三碳与碳反应生成物都是低价氧化物的化学反应式:
。
若按此反应进行还原1mol四氧化三铁,固体物质的质量减少 g.
(2)分别取116g四氧化三铁,加入足量的铁粉加热反应后产物分别如下表ABCD所列:
|
编号 |
产物 |
|
A |
FeO CO2 |
|
B |
FeO CO |
|
C |
Fe CO2 |
|
D |
Fe CO |
反应中生成气体在标准状况下的最大体积为 L,固体减少的质量最小为 g。
(3)与1mol四氧化三铁作用,从反应开始至反应结束消耗碳的质量mC的可能的范围为 。
(4)如果反应中产生的气体只有CO2,反应作用掉的碳的质量为Xg,则反应生成的固体产物m的取值范围为(用含X的函数表示) 。
(5)如果反应中生成的都是铁,测得反应产生的气体的密度折算到标准状况下为1.429g/L,反应中固体质量减小256g,则反应中生成铁的质量为多少?
31、(1)3.00 ( 2分) (2)67.2g
(2分)
( 2分) (2)67.2g
(2分)
|
(3)剩余固体的组成 |
m的取值范围 |
n的取值范围 |
|
只有铜 |
0<m≤67.2 |
0<n≤76.8 |
|
有铁且有铜 |
m>67.2 |
m-67.2<n≤m + 9.6 |
(4)2.5
31、(奉贤一)(10分)电子工业常用一定浓度的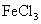 溶液腐蚀敷有铜箔的绝缘板,制成印刷线路板.有关反应为:2FeCl3
+ Cu = CuCl2 + 2FeCl2
溶液腐蚀敷有铜箔的绝缘板,制成印刷线路板.有关反应为:2FeCl3
+ Cu = CuCl2 + 2FeCl2
现将一块敷有铜箔的绝缘板浸入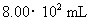 某
某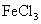 溶液A中,一段时间后,将该线路板取出,向所得溶液B中加入铁粉m g,充分反应后剩余固体n g;将固体滤出并从滤液C(忽略反应前后溶液体积的变化)中取出20.00 mL,向其中滴入
溶液A中,一段时间后,将该线路板取出,向所得溶液B中加入铁粉m g,充分反应后剩余固体n g;将固体滤出并从滤液C(忽略反应前后溶液体积的变化)中取出20.00 mL,向其中滴入 溶液60.00 mL时,溶液中的
溶液60.00 mL时,溶液中的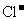 恰好完全沉淀.请计算:
恰好完全沉淀.请计算:
(1)溶液A中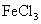 的物质的量浓度为_________________
的物质的量浓度为_________________ ;
;
(2)假若铁粉不再溶解,向溶液B中加入的铁粉质量至少应当大于______________g;
(3)讨论当剩余固体的组成不同时m与n可能的取值范围,并填入下表
|
剩余固体的组成 |
m的取值范围 |
n的取值范围 |
|
只有铜 |
|
|
|
有铁且有铜 |
|
(用含m的代数式表示) |
(4)当m=100.0,n=96.8时,溶液B中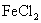 的物质的量浓度为________
的物质的量浓度为________ .
.
5、(闸北二)下列关于“物质的量”、“摩尔”和“摩尔质量”的叙述中正确的是( )
A.物质的摩尔质量等于其相对分子(原子)质量
B.“物质的量”是国际单位制中的一个基本单位
C.0.012 kg 12C中所含的碳原子数为NA
D.1mol任何物质都含有约6.02×1023个原子
1.(南汇二)下列物质名称和括号内化学式对应的是( )
A.纯碱(NaOH) B.甲醛(CH3OH) C.石膏(CaSO4·2H2O) D.生石灰[Ca(OH)2]
1.(静安二)《新科学家》2009年1月10日报道,通过取样分析,目前地球大气中二氧化碳的水平是385ppm,带来了明显的温室效应。“ppm”是一种 ( )
A.浓度单位 B.质量单位 C.体积单位 D.长度单位
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com