
18、一定体积0.01mol/L的稀硝酸溶液恰好能氧化一定质量的铁、铝混合物,已知两种金属均被氧化为最高价态,还原产物只有NO。若用0.01mol/L的NaOH溶液溶解相同质量的该混合物,当反应完全时所需氢氧化钠溶液的体积是稀硝酸溶液的1/5,则样品中铁、铝的物质的量之比为( )
A.2:3 B.1:3 C.1:4 D.5:3
17、下列说法中正确的是( )
A、在一体积不变的密闭容器中,反应2NO2(g)  N2O4(g) ΔH<0,达平衡后加热,容器内气体的平均摩尔质量减小,但气体的密度不变
N2O4(g) ΔH<0,达平衡后加热,容器内气体的平均摩尔质量减小,但气体的密度不变
B、在一体积和温度不变的容器中,进行反应H2(g)+I2(g)
 2HI(g) ΔH<0,若容器内的压强不变,表明反应已达平衡状态,且反应从开始至达到平衡状态的过程中,容器向外放热
2HI(g) ΔH<0,若容器内的压强不变,表明反应已达平衡状态,且反应从开始至达到平衡状态的过程中,容器向外放热
 C、在一温度和压强不变的密闭容器中,充入一定量的SO3发生反应2SO3 (g) 2SO2(g)+O2(g),达平衡后,再向容器中充入一定量的SO3,重新达到平衡时,SO3的体积分数增加
C、在一温度和压强不变的密闭容器中,充入一定量的SO3发生反应2SO3 (g) 2SO2(g)+O2(g),达平衡后,再向容器中充入一定量的SO3,重新达到平衡时,SO3的体积分数增加
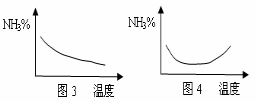
D、四个体积相等的密闭容器,四位同学分别于不同的温度下,按物质的量1:3的比例在其中分别充入等量的N2和H2合成氨,当反应进行到10分钟时,每人均测定各自四个容器中NH3的体积分数并分别作图如下,则图2肯定错误

16、A是一种常见的单质,B、C为常见的化合物,A、B、C均含有元素x,它们有如图所示的转化关系(部分产物及反应条件已略去)。下列说法中正确的是 ( )
A.X元素可能为铝
B.反应①和②互为可逆反应
C.X元素可能是金属,也可能是非金属
D.反应①和②一定为氧化还原反应
15、有BaCl2和NaCl的混合溶液aL,将它均分成两份。一份滴加稀硫酸,使Ba2+完全沉淀,另一份滴加AgNO3溶液,使Cl-完全沉淀。反应中消耗xmolH2SO4、ymolAgNO3.据此得知,原混 合溶液中的c(Na+)mol/L为( )
合溶液中的c(Na+)mol/L为( )
A (y-2x)/a B (y-x)/a C (2y-2x)/a D (2x-4y)/a
14、25.C 1×105Pa下,使VL氯化氢气体溶于水的VL水溶液,关于这种溶液的叙述正确的是( )
A. 溶液的物质的量浓度为1mol/L B. 溶液中c(H+)=
 C.溶液中水分子数和H+ 数之比为1:1 D.溶液的物质的量浓度稍小于
C.溶液中水分子数和H+ 数之比为1:1 D.溶液的物质的量浓度稍小于
13、如右图所示,向A、B中均充入1mol x、l
rnol Y,起始时A、B的体积都等于a L。在相 同温度、外界压强和催化剂存在的条件下,关闭活塞K,使两容器中都发生下述反应:
同温度、外界压强和催化剂存在的条件下,关闭活塞K,使两容器中都发生下述反应:
X(g)+Y(g) 2Z(g)+W(g) △H<O。达平衡时,A的体积为1.4aL。下列说法错误的是 ( )
2Z(g)+W(g) △H<O。达平衡时,A的体积为1.4aL。下列说法错误的是 ( )
A.反应速率:v(B)>v(A) B.A容器中x的转化率为80%
C.平衡时的平均摩尔质量:MB<MA D.平衡时Y体积分数:A<B
12、用惰性电极电解一定质量的某浓度的NaCl溶液,一段时间后停止电解。此时若加入100g36.5%的浓盐酸,所得溶液正好与原溶液完全相同,则电解过程中转移电子的物质的量约为( )
A 6mol B 7mol C 8mmol D 9mol
11、在一定条件下,某密闭容器中发生反应:2SO2(g)+O2(g) 2SO3(g);ΔH=-196.6 ?kJ·mol-1。反应达平衡后,SO2、O2、SO3的物质的量之比为3∶2∶4,其他条件不变,升高温度,达到新的平衡时,n(SO2)=1.4 mol,n(O2)=0.9 mol,则此时SO3的物质的量为
2SO3(g);ΔH=-196.6 ?kJ·mol-1。反应达平衡后,SO2、O2、SO3的物质的量之比为3∶2∶4,其他条件不变,升高温度,达到新的平衡时,n(SO2)=1.4 mol,n(O2)=0.9 mol,则此时SO3的物质的量为
A.1.4 mol B.1.6 mol C.1.8 mol D.2.0 mol
10、下列叙述不正确的有( )
A.根据金属活动性顺序表,可以推断冶炼金属时可能的方法
B.根据某元素各原子的质量数以及所占的百分含量,可以确定该元素的近似相对原子质量。
C.依据溶液导电能力的大小,将电解质分为强、弱电解质
D.根据元素周期表中元素的位置,可以寻找合适的半导体材料
9、著名化学家徐光宪获得2008年度“国家最高科学技术奖”,以表彰他在稀土串级萃取理论方面作出的贡献。稀土铈(Ce)元素主要存在于独居石中,金属铈在空气中易氧化变暗,受热时燃烧,遇水很快反应。已知:铈常见的化合价为+3和+4,氧化性:Ce4+>Fe3+。下列说法正确的是
A.电解熔融Ce02制Ce,铈在阳极获得
B.铈溶于氢碘酸的化学方程式可表示为:Ce+4HI=CeI4+2H2↑
C.用Ce(S04)2溶液滴定硫酸亚铁溶液,其离子方程式为:Ce4++2Fe2+=Ce3++2Fe3+
D.四种稳定的核素13658Ce、13858Ce、14058Ce、14258Ce,它们互称为同位素
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com