
32、(1) N溶液中不含CO32-、SO42-(或M溶液中含有CO32-、SO42-)(2分)
(2) M (1分) N溶液中含有大量的H+、Fe2+,在大量的H+存在下Fe2+与NO3-发生氧化还原反应。(2分)
(3) N (1分)除Cl-外其他阴离子均存在于M溶液中,可以确定Cl-存在于N溶液中(或溶液呈电中性)(2分)
31、(1)
(1分)
 (2)O<S
<P< Na (2分)
(2)O<S
<P< Na (2分)
(3)H2SO3 + Br2 + H2O = 4H+ + SO42- + 2Br- (1分)
(4)P2O5+3H2O(热)=2H3PO4 (2分)
 (5)Na2O2
+ S2- + 2H2O = 2Na+
+ S + 4OH- (3分)
(5)Na2O2
+ S2- + 2H2O = 2Na+
+ S + 4OH- (3分)
(6)Na2S + 2H2O S↓+ H2↑+ 2NaOH(3分)
生成的NaOH可循环利用,副产氢气可以作为化工原料或燃料 (2分)
36、(12分)已知A、B、C、D是短周期中的四种非金属元素,它们的原子序数依次增大,四种元素的原子最外层电子数之和为16,A与B、C、D之间均可形成含有10个电子或18个电子的化合物,且A、D组成的化合物在常温下呈液态。
(1)A、C两种元素组成的10个电子化合物的分子的空间构型是 ,属于 (填极性、非极性)分子。
(2)B单质在高温下可从A与D组成的某种化合物中置换出A,同时生成化合物BD,该反应的化学方程式为 。
(3)A、C、D三种元素原子半径由小到大的顺序是(用元素符号表示) ;由A与C、 A与D构成的两种分子,结合H+的能力______强(填化学式),用离子方程式表示这一事实: 。
(4)A、B、D三种元素形成的具有18个电子的化合物的结构简式为 。
(5)这四种元素可组成原子个数比为5:1:1:2(按A、B、C、D顺序)的化合物,其名称为 。
2009-2010学年度上学期高三第四次调研考试
高三年级化学试卷
答案:BACAC DBCDC ACCDD DACCA CDDCA DCABC
35、(10分)X、Y、Z为周期表中前20号主族元素,原子序数递增,X、Y原子的最外层电子数是其电子层数的2倍,Z是人体含量最高的金属元素。
(1) 下列含氧酸根化学式书写不正确的是 (填序号)。
a.X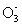 b.X
b.X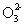 C.Y
C.Y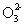 d.Y2
d.Y2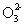 e X2O42- f XO42-
e X2O42- f XO42-
(2) Y的最高价含氧酸是重要的化工产品。
①实验测得相同条件下一定量的Y单质分别在空气和在氧气中充分燃烧后产物的成分(体积分数)如表。
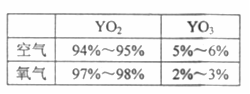
Y在纯氧中燃烧产物里YO3含量比空气中少的原因是 。
②天然ZYO4既可用于制备Y的氧化物又可用于制水泥。ZYO4与X单质在高温下反应,得到两种常见气体。每消耗1 molX单质,有4 mol电子转移,该反应的化学方程式是:
。
(3) 为了测定某水泥样品成分,称取10.0g样品,将其中的Z元素转化为ZX2O4沉淀,将沉淀用稀酸处理得H2X2O4溶液,取该溶液体积的1/100,用KMnO4溶液滴定(氧化产物为XO2,还原产物为Mn2+),结果用去0.0200 mol·L-1。的KMnO4溶液24.00mL。该样品中Z的氧化物的质量分数是 。
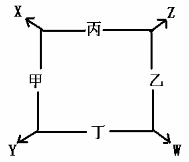
34、 (8分)如图所示:
①已知甲、乙、丙、丁均为前三周期元素的单质。
② 在一定的条件下甲与丙和甲与丁都按物质的量之比1:3
反应,分别生成X和Y,在产物中元素甲呈负价。
③在一定条件下乙与丙和乙与丁都按物质的量之比1:2反应,
分别生成Z和W,在产物中元素乙呈负价。 填空:
(1)甲是___________,乙是____________
(2)甲与丙反应生成X的化学方程式______________________________
(3)乙与丁反应生成W的化学方程式为____________________________________
33、(8分)
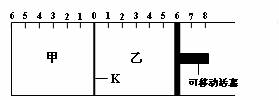
如图所示,甲、乙之间的隔板K可以左右移动,甲中充入2molA和1molB,乙中充入2molC和1molHe,此时K停在0处。在一定条件下发生可逆反应:2A(g)+B(g)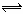 2C(g),反应达到平衡后,恢复到反应发生前时的温度。
2C(g),反应达到平衡后,恢复到反应发生前时的温度。
填写下列有关空白:
(1) 根据隔板K滑动与否______(填“能”或“不能”)
判断左右两边的反应是否达到平衡。
(2) 达到平衡后,隔板K最终停留在左侧刻度__________位置。
(3) 到达平衡时,甲容器中A的物质的量______乙容器中A的物质的量(填“>”、“<”或“=”)。
(4) 若平衡时K停留在左侧1处,则活塞仍停留在右侧______(填序号)。
A.右侧6处 B.右侧6~7处 C.右侧7处 D.右侧7~8处
32、(8分)有M、N两种溶液,经测定共含有10种离子(不考虑水的电离):Na+、K+、Fe2+、NH4+、H+、Cl-、NO3-、OH-、CO32-、SO42-。现取少量M、N溶液进行如下实验:
①取少量N溶液,滴加足量的Ba(NO3)2溶液,无沉淀产生;
②取M 溶液进行焰色反应,焰色为黄色;透过蓝色钴玻璃观察,不呈紫色。
根据以上实验,回答下列问题:
(1) 由实验①得出结论为____________________________________________________
(2) NO3-存在于_______(填M或N)溶液中,理由是________________________
(3) Cl-存在于_______(填M或N)溶液中,理由是___________________
31、(14分)A、B、C、D四种均为短周期元素,原子序数依次增大
(1)A元素原子最外层电子数是核外电子层数的3倍,A与D同主族,A和D可形成两种化合物X和Y,X和水反应后生成一种具有还原性的二元酸M,M可以使溴水褪色。
(2)A元素的单质和C元素的单质化合可生成Z, Z在加热条件下跟水反应的产物1 mol需用3mol KOH才能完全中和。
(3)A元素的单质和B元素的单质一定条件下反应生成化合物N,D元素的单质和B元素的单质反应生成化合物G,化合物N和化合物G的相对分子质量相等,且焰色反应均呈黄色。
回答下列问题:
(1)画出元素D的离子结构示意图:__________ ___;
(2)A、B、C、D四种元素的原子半径按由小到大排列的顺序为(用相应的元素符号表示):
_____________________________ ____
(3)M可以使溴水褪色,写出该反应的离子方程式 ;
(4)Z与热水反应的化学方程式 。
(5)化合物N与化合物G的水溶液反应,若氧化剂与还原剂物质的量之比为1:1,该反应的离子方程式为
(6)常温下,D的氢化物呈气态,有毒,水溶液呈酸性。脱除天然气中D的氢化物既能减少环境污染,又可回收D的单质。
用过量NaOH溶液吸收D的氢化物后,以石墨作电极电解该溶液可回收D的单质,其电解总反应的化学方程式(忽略溶解氧的氧化还原反应)为__________ ;
该方法的优点是_______________ _____ 。
30、右表是元素周期表的一部分。X、Y、Z、W均为短周期元素,X、W的质子数之和为23。
|
|
X |
|
Y |
|
Z |
|
W |
|
下列说法正确的是
A.X元素最多可形成五种氧化物
B.W元素的非金属性比Z元素非金属性弱
C.Z和X能以共价键结合形成一种无机非金属材料
D.Y元素的最高价氧化物的水化物是含氧酸中酸性最强的
非选择题部分(60分)
29、下列关于晶体结构和性质的叙述不正确的是
A.在氯化钠晶体中每个Cl-周围同时吸引6个Na+,在氯化铯晶体中每个Cl-周围同时吸引8个Cs+
B.氯化钠、氯化铯和二氧化碳的晶体都具有立方的晶胞结构,它们具有相似的物理性质
C.干冰晶体是分子晶体,其中不仅存在分子间作用力,也存在共价键
D.在二氧化硅晶体中,平均每个Si原子形成4个Si一O共价单键
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com