
28、已知酸式盐NaHB在水溶液中存在下列反应:
①NaHB==Na++HB-,②HB- H++B2-,③HB-+H2O
H++B2-,③HB-+H2O H2B+OH-
H2B+OH-
且溶液中c(H+)>c(OH-),则下列说法一定正确的是( )
A、NaHB为强电解质
B、H2B为强酸
C、NaHB溶液中仅存在HB-、B2-两种含B元素的离子
D、HB-的电离程度小于HB-的水解程度
27、下列关系图中,A是一种正盐,B是气态氢化物,C是单质,F是强酸。当X无论是强酸还是强碱时都有如下转化关系(其他反应产物及反应所需条件均已略去),当X是强碱时,过量的B跟Cl2反应除生成C外,另一产物是盐酸盐。

下列说法中不正确的是( )
A.当X是强酸时,A、B、C、D、E、F中均含同一种元素,F可能是H2SO4
B.当X是强碱时,A、B、C、D、E、F中均含同一种元素,F是HNO3
C.无论X是强酸还是强碱时,上面的一系列反应中都需要经历3个化合反应
D.A是一种离子化合物
26、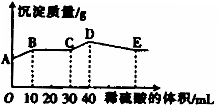 将由NaOH、
将由NaOH、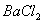 、
、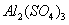 三种固体组成的混合物溶于足量的水中,充分溶解,向混合物液中滴加1mol·L-1的稀硫酸,加入稀硫酸的体积与生成沉淀的质量关系如图所示。下列有关判断不正确的是( )
三种固体组成的混合物溶于足量的水中,充分溶解,向混合物液中滴加1mol·L-1的稀硫酸,加入稀硫酸的体积与生成沉淀的质量关系如图所示。下列有关判断不正确的是( )
A、 AB段发生反应的的离子方程式为:
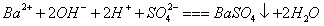
B、 BC段发生反应的离子方程式为: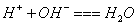
C、 D点表示的沉淀的化学式为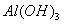 、
、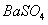
D、 E点表示的溶液呈中性
25、下列叙述不正确的是( )
A 最外层电子数为偶数的短周期元素不会与卤素或氢形成最简式为AB3型的化合物
B 由短周期元素组成的A2B3型化合物中A、B元素的原子序数的差值可能为1、3、5
C 稀有气体不活泼的原因是它们原子的最外层都达到8电子或2电子的稳定结构
D 已经发现的元素中,最外层电子数分别为1、2、3、4、5、6的元素,可能是非金属元素也可能是金属元素
24、下列反应的离子方程式正确的是
A.过量SO2通入到Ba(NO3)2溶液中:3SO2+2NO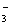 +3 Ba
+3 Ba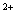 +2H2O=3
BaSO4↓+2NO+4H
+2H2O=3
BaSO4↓+2NO+4H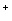
B.铝铵矾[NH4Al(SO4)2·12H2O]溶液中加入过量Ba(OH)2溶液:
Al3++2SO42-+2Ba2++4OH-=AlO2-+2BaSO4↓+2H2O
C.H2O2溶液中滴加酸性KMnO4溶液: 2 MnO4-+5 H2O2+6H+=2Mn2++5O2↑+8H2O
D少量NaHSO4溶液与足量Ba(OH)2溶液反应离子方程式为:
2H++SO2-4+Ba2++2OH-=BaSO4↓+2H2O
23、对于反应N2O4(g)
 2NO2(g)在温度一定时,平衡体系中NO2的体积分数ψ(NO2)
2NO2(g)在温度一定时,平衡体系中NO2的体积分数ψ(NO2)
随压强的变化情况如图所示(实线上的任何一点为对应压强下的平衡点),下列说法正确
的是( )
A.A、C两点的正反应速率的关系为A>C
B.A、B、C、D、E各状态中,v(正)<v(逆)的是状
态E
C.维持p1不变,E→A所需时间为x;维持p2不变,
D→C所需时间为y,则x<y。
D.使E状态从水平方向到达C状态后,再沿平衡曲线到达A状态,从理论上来讲,可选用的条件是从p1突然加压至p2,再由p2无限缓慢降压至p1
22、时钟反应或振荡反应提供了迷人课堂演示实验,也是一个活跃的研究领域。测定含I-浓度很小的碘化物溶液时,利用振荡反应进行化学放大,以求出原溶液中碘离子的浓度。主要步骤是
①在中性溶液中,用溴将试样中I-氧化成IO3-,将过量的溴除去
 ②再加入过量的碘化钾,在酸性条件下,使IO3-完全转化成I2
②再加入过量的碘化钾,在酸性条件下,使IO3-完全转化成I2
③将②中生成的碘完全萃取后,用肼将其还原成I-,方程式为H2N-NH2+2I2→4I-+N2↑+4H+
④将生成的I-萃取到水层后用①法处理。
⑤将④得到的溶液加入适量的KI溶液,并用硫酸酸化。
⑥将⑤反应后的溶液以淀粉作指示剂,用Na2S2O3标准溶液滴定,方程式为:
2 Na2S2O3+I2→Na2S4O6+2NaI
经过上述放大后,则溶液中I-浓度放大为原溶液中I-浓度的(设放大前后溶液体积相等) ( )
A.2倍 B.4倍 C.6倍 D.36倍
21、以下对元素非金属性的比较正确的是( )
A.由“同温度下等浓度的Na2CO3溶液比Na2SO3溶液的pH大,可知C比S非金属性弱
B.由“形同浓度的H2S溶液比HI溶液的酸性弱”,可知S比I元素非金属性的弱
C.由“HF比HCl稳定性好”,可知F比Cl 非金属性的强
D.由“SO2中O显 -2价”,不能得出O比S非金属性强的结论
20、一定条件下,将X和Y两种气体按不同比例放入固定容积的密闭容器中,反应达平衡后,测得X、Y的转化率与起始时物质的量之比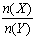 的关系如图1。改变温度和压强,生成物Z的百分含量如表1,则该反应的化学方程式可表示为
的关系如图1。改变温度和压强,生成物Z的百分含量如表1,则该反应的化学方程式可表示为
|
温度/℃ |
压强/kPa |
Z的质量分数 |
|
200 |
101 |
0.40 |
|
300 |
101 |
0.48 |
|
400 |
202 |
0.52 |
|
400 |
303 |
 0.52 0.52 |
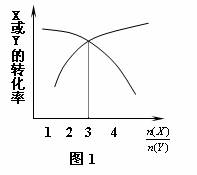
A.3X(g)+Y(g) 4Z(g);ΔH>0
4Z(g);ΔH>0
B.X(g)
+ 3Y(g) 4Z(g);ΔH>0
4Z(g);ΔH>0
C.3X(g)+Y(g) 3Z(g);ΔH<0
3Z(g);ΔH<0
D.X(g)+3Y(g) 3Z(g);ΔH<0
3Z(g);ΔH<0
19、短周期元素X、Y、Z的离子具有相同的核外电子排布,原子半径X大于Z,离子半径Y大于Z,Y与Z可形成常见的离子化合物,则下列说法中不正确的是
A.原子序数一定是Z>X>Y
B.X、Z两种元素的单质的沸点一定是Z>X
C.Z的最高价氧化物一定能溶于X、Y的最高价氧化物的水化物
D.工业上获得X、Z单质的方法主要是电解
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com