
10. 将Na2CO3转变为NaHCO3,可采取持续不断的通入CO2气体的方法Na2CO3+CO2+H2O=2NaHCO3,NaHCO3转变为Na2CO3可采取加热的方法,也可以采取滴加适量NaOH的方法NaHCO3+NaOH=Na2CO3+H2O
9. 焰色反应为物理变化而不是化学变化,它体现了元素的性质
8. 碱金属从Li→Rb熔沸点逐渐降低
7. 向Na2CO3与NaOH的混合溶液中逐滴滴加稀盐酸,首先考虑HCL+NaOH=NaCL+H2O再考虑5
6. NaOH与NaHCO3不能共存,无论混溶于水或加热,首先考虑二者之间的反应 NaHCO3+NaOH=Na2CO3+H2O
5. 将Na2CO3溶液逐滴加入稀盐酸中,马上就会释放出气体。
Na2CO3+2HCL=2NaCL+H2O+CO2↑,而将稀盐酸逐滴加入Na2CO3溶液中则开始无气泡,后来产生气泡。Na2CO3+HCL=NaHCO3+NaCL NaHCO3+HCL=NaCL+H2O+CO2↑可利用这种正反滴加来鉴别盐酸与Na2CO3
4. 有时向Na2O2固体上滴加酚酞试液,开始变红,后来褪色,那是因为Na2O2的强氧化性和漂白作用
3. NaHCO3受热易分解,Na2CO3则不易
1. Na2O的稳定性要小于Na2O2,所以Na2O在加热情况下与O2反应变成Na2O2
* 2. NaHCO3溶解度Na2CO3溶解度,所以向饱和Na2CO3溶液中通CO2会析出NaHCO3晶体
2.碱金属的性质规律与特例
(1)通常合金多呈固态,而钠钾合金却是液态。
(2)碱金属单质在空气或氧气中燃烧时,生成过氧化物甚至比过氧化物更复杂的氧化物,而Li只生成Li2O。
(3)碱金属单质密度一般随核电荷数增大而递增,但K的密度比Na小。
(4)碱金属单质一般跟水剧烈反应,但Li跟水反应缓慢(LiOH溶解度小)。
(5)碱金属单质因其活动性强,多保存在煤油中,而Li却因密度比煤油更小,只能保存在液体石蜡中。
(6)碱金属的盐一般都易溶于水,但Li2CO3却微溶。
(7)一般说,酸式盐较正盐溶解度大,但NaHCO3却比Na2CO3溶解度小。
(8)试剂瓶中的药品取出后,一般不能放回原瓶,但IA金属Na、K等除外。
(9)一般活泼金属能从盐中置换出不活泼金属,但对IA非常活泼的金属Na、K等除外。如:2Na+CuSO4+2H2O Cu(OH)2↓+H2↑+Na2SO4。
Cu(OH)2↓+H2↑+Na2SO4。
(10)Fr是放射性元素,所以在自然界中不存在。
[例4] 下列有碱金属铷(Rb)的叙述中,正确的是 ( )
A.灼烧氯化铷时,火焰有特殊颜色 B.硝酸铷是离子化合物,易溶于水
C.在钠、钾、铷三种单质中,铷的熔点最高 D.氢氧化铷是弱碱
[解析]与钠元素相似,铷元素也有焰色反应,选项A正确;与NaNO3相似,RbNO3是离子化合物,易溶于水,选项B正确;碱金属从锂到铯,熔点逐渐降低,选项C错误;碱金属的氢氧化物均为强碱,选项D错误。
[答案]AB。
[备考反思]由所学物质的结构、性质来推断结构相似、未学物质的性质,是中学化学重要的一类习题。解答此类题目的关键就是要考虑二者的相似性和递变性。对碱金属元素单质及其化合物的性质的相似性和递变性及特殊性一定要熟悉。
知识总结
有关钠反应的框图
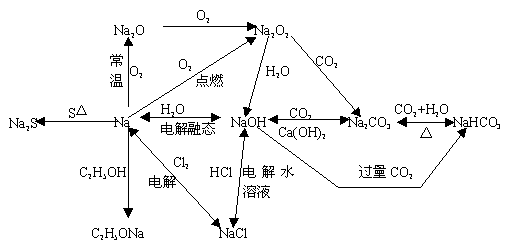
本章知识结构体系及要注意的几点问题
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com