
1.在相同温度下等体积、等物质的量浓度的4种稀溶液:①Na2SO4,②H2SO3,③NaHSO3,④Na2S中所含带电微粒数由多到少的顺序是 ( )
A.①=④>③=② B.④=①>③>② C.①>④>③>② D.④>①>③>②
6.物料平衡
所谓物料平衡即电解质发生电离或水解前某元素的原子(或离子)的物质的量应等于电解质溶液中所有含该元素的微粒中原子(或离子)的总的物质的量。
[例6].在0.1mol/L的NaHCO3溶液中,下列各关系式正确的是 (. )
A.c(Na+)> c(HCO3-)> c(H +)> c(OH-)
B.c(Na+)+c(H +) = c(HCO3-)+ c(OH-)+2c(CO32-)
C.c(Na+)= c(HCO3-)> c(OH-)> c(H +)
D.c(Na+) = c(HCO3-)+c(CO32-)+ c(H2CO3)
[解析]由物料平衡可知HCO3-的初始浓度应该等于电离和水解分别达平衡时各产物及剩余HCO3-的浓度之和,即c(HCO3-)初始 =c(CO32-)+c(HCO3-)c(H2CO3),因c(Na+)= c(HCO3-)初始 ,所以答案D正确,在从电荷平衡的角度知答案B也正确,故本题答案为BD。
排列溶液中微粒浓度的大小顺序专题训练
5.电荷平衡
[例5]常温下,将甲酸和氢氧化钠溶液混合,所得溶液pH=7,则此溶液中 ( C )
A.c(HCOO-)>c(Na+) B.c(HCOO-)<c(Na+)
C.c(HCOO-)=c(Na+) D.无法确定c(HCOO-)与c(Na+)的关系
[解析]在甲酸与氢氧化钠溶液混合中共含HCOO- 、H+、 Na+ 、OH-四种离子,根据溶液中电荷平衡原理,c(HCOO-)+c(OH-)= c(H +)+c(Na+),已知所得溶液pH=7,即知c(OH-)= c(H +),所以易推知c(HCOO-)=c(Na+),答案为C。
4.共轭平衡
[例4]将PH=3盐酸溶液和PH=11的氨水等体积混合后,溶液显碱性,溶液中离子浓度关系正确的是( )
A.c(NH4+)> c(Cl-)> c(H+)> c(OH-)
B.c(NH4+)> c(Cl-)> c(OH-)> c(H+)
C.c(Cl-)> c(NH4+)> c(H+)> c(OH-)
D.c(Cl-)> c(NH4+)> c(OH-> c(H+))
[解析]由题意知,混合前两溶液中[H+]=[OH-]=[HCl]=1×10-3 mol·L-1,由于NH3·H2O是弱电解质部分电离,故反应前c(NH3·H2O) 〉c(HCl),两溶液混合后反应,NH3·H2O过量,反应后得到NH3·H2O和NH4Cl的混合溶液,混合溶液中NH3·H2O的电离与NH4+的水解形成共轭平衡关系:NH3·H2O NH4+ +OH-,NH4+ +H2O
NH4+ +OH-,NH4+ +H2O NH3·H2O+H+,由于NH3·H2O的电离能力大于NH4+的水解能力,所以c(NH4+)> c(Cl-),且溶液显碱性,答案为B。
NH3·H2O+H+,由于NH3·H2O的电离能力大于NH4+的水解能力,所以c(NH4+)> c(Cl-),且溶液显碱性,答案为B。
3.水解平衡
[例3]5 mL0.2 mol·L-1KOH溶液与10 mL0.1mol·L-1的醋酸混合,在所得溶液中( )
A.c(K+)〉c(CH3COO-) 〉c(H+)〉c(OH-)
B.c(K+)〉c(CH3COO-) 〉c(OH-) 〉c(H+)
C.c(K+)〉c(CH3COO-) 〉c(OH-) =c(H+)
D.c(K+)=c(CH3COO-) 〉c(OH-) 〉c(H+)
[解析]由题意知,CH3COOH与KOH等物质的量反应,产物CH3COOK为强碱弱酸盐,由于在溶液中存在水解平衡:CH3COO-+H2O CH3COOH+OH-,所以
CH3COOH+OH-,所以
c(K+)〉c(CH3COO-),且溶液显碱性,故答案应选B。
2、电离平衡
[例2]下列溶液中,c(OH-)最小的是 ( )
A.向0.1mol·L-1的NaOH溶液中加入同体积的蒸馏水
B.向0.1mol·L-1的氨水中加入同体积的蒸馏水
C.向0.2mol·L-1的NaOH溶液中加入同体积的0.1mol·L-1盐酸
D.向0.2mol·L-1的氨水中加入同体积的加入同体积的0.1mol·L-1盐酸
[解析]由提给条件易算出:A、C两种溶液中NaOH的浓度均为0.05 mol·L-1,B、D两种溶液中氨水的浓度均为0.05 mol·L-1。由于NaOH是强碱完全电离,可见A、C两种溶液中c(OH-)均为0.05 mol·L-1;NH3·H2O是弱电解质部分电离,在B、D两种溶液中均存在电离平衡:NH3·H2O NH4+ +OH-,故B、D中c(OH-)均小于0.05 mol·L-1,又由于D中存在较多的NH4+,使电离平衡向逆反应方向移动,故D中c(OH-)最小。
NH4+ +OH-,故B、D中c(OH-)均小于0.05 mol·L-1,又由于D中存在较多的NH4+,使电离平衡向逆反应方向移动,故D中c(OH-)最小。
1、溶解平衡
[例1]若把足量的AgCl分别投入①10mL蒸馏水②10mL 0.1mol·L-1 NaCl溶液③10mL 0.1mol·L-1AlCl3溶液④10mL 0.1mol·L-1CaCl2溶液中,搅拌后在相同温度下Ag+浓度由大到小的顺序为 。
[解析]所给蒸馏水、NaCl溶液、AlCl3溶液和CaCl2溶液,其c(Cl-)从小到大的顺序是:①〈②〈④〈③。由溶解平衡知识知:当AgCl溶解达到平衡时,Ag+和Cl-物质的量浓度之积为一定值,可见溶液中[Cl-]越大, AgCl在其中的溶解度越小,故[Ag+]浓度由大到小的顺序为①〈②〈④〈③.
43.下图中弧线BD为昏线,读后回答下列问题。(10分)
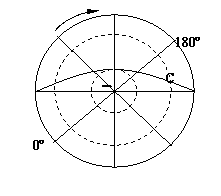
⑴该图表示的是北半球 _________日(节气)(2分)
⑵图中B点的经纬度位置:纬度 ___,经度 ______,A点此时的地方时是 时,C处此时的太阳高度是 ___ 度。(4分)
⑶这一天中,A、B、C三地中正午太阳高度最大的地方是 ___,黑夜时间最长
的地方是 _________ 。(2分)
⑷这一天天津昼 ___ (长、短)于夜,此日之后白昼将渐渐变 ___。(2分)
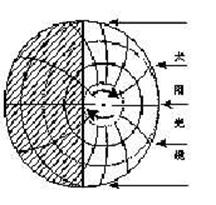
 44.读下图回答:(12分)
44.读下图回答:(12分)
(1)此图所画的大地球表示________月_______日、节气为______的日照状况图;(3分)
(2)此时阳光直射在___________纬线上,正午太阳高度的分布规律是___________________________________________________________。(4分)
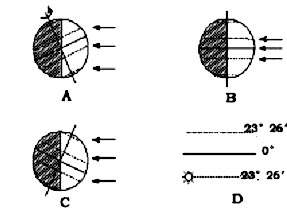
(3)此大图与右图___________________图日期相同(选择填空);(2分) (4)此图所示时间过半年后,太阳直射点的移动方向是___________ _____ (2分)
42.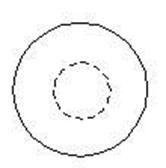
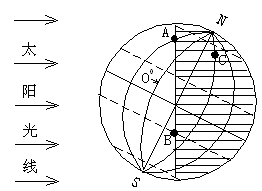 读地球光照图,回答: (10分)
读地球光照图,回答: (10分)
(1)此时地球上太阳直射点的地理坐标是:纬度 _,经度 ____(2 分)
(2)此时地方时为0时的经线是 ______________。 (1分)
(3)此图所表示的当天,赤道上日出的时间是 _________,南极圈上日落的时间是 _______________________。(2分)
(4)A.,B,C三点该日中黑夜最短的是___________________点。(1分)
(5)将此图改画成以北极为中心的俯视图,在图上画出 : (4分)
①平行的太阳光线 ②晨昏线 ③用阴影表示黑夜 ④标出地球自转的方向。
41.读“地球公转轨道图”(从北极上空垂直俯视轨道平面),回答:(8分)
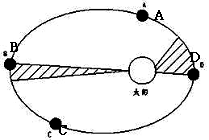
(1)在公转轨道上用箭头标出地球公转方向。 (1分)
(2)在A、B、C、D四点中,近日点位于____________点,每年__________月初地球经过此点;远日点位于__________点,每年________月初地球经过此点。(4分)
(3)A、B、C、D四点中日地距离比较,由近到远的排列依次是__________ (1分)
(4)A、B、C、D四点公转速度比较,角速度、线速度从大到小的排列依次应该是:
_____________________________ ( 2分)
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com