
2.下列有关细胞结构和功能的叙述中,不正确的是
A.蓝藻、结核杆菌和酵母菌三者都有细胞膜、核糖体和DNA
B.抑制膜上载体活性的毒素会阻碍根细胞吸收无机盐离子
C.精细胞和根尖分生区细胞虽然不断进行着自我更新,但并非都有细胞周期
D.能将二氧化碳和水合成有机物的细胞都含有叶绿体
1. 细菌、放线菌和蓝藻等细胞与动、植物细胞相比其主要不同是
A. 没有以生物膜为基础构成的核膜和细胞器
B. 遗传信息量少,以一个环状DNA分子为载体
C. 体积小,进化地位原始 D. 分布广泛,对生态环境的适应性强
21、把NaOH、MgCl2、AlCl3三种固体组成的混合物溶于足量水后有1.16 g白色沉淀,在所得的悬浊液中逐滴加入1 mol·L-1 HCl溶液,加入HCl溶液的体积V与生成沉淀的质量m的关系如图所示,试回答:
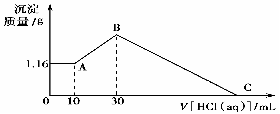
(1)A点沉淀物的化学式为 ;AB段发生的离子反应方程式为:
(2)原混合物中的MgCl2与AlCl3的物质的量之比为 , NaOH的物质的量为
(3)HCl溶液在C点的加入量是
株洲市二中2008年下学期高三年级第三次月考
20、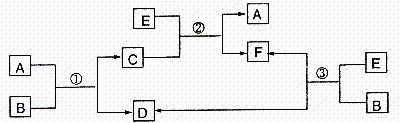 A、B、C、D、E、F六种物质在一定条件下有如图所示的相互转化关系,所有反应物和生成物均已给出。
A、B、C、D、E、F六种物质在一定条件下有如图所示的相互转化关系,所有反应物和生成物均已给出。
(1)若反应①、②、③均为溶液中的置换反应,A、D、E为卤素单质,D能使淀粉溶液变为蓝色,B的焰色反应为黄色,则A、D、E的氧化性由强到弱的顺序为(填化学式) ,反应②的化学方程式是:
(2)若B是一种淡黄色固体,绿色植物的光合作用和呼吸作用可实现自然界中D、E的循环,反应③、①是呼吸面具中发生的反应,则反应①的离子方程式是:
在反应③中,若生成1molD,则转移的电子数目为
18、在社会实践调查活动中,某同学观察到某乡镇颜料厂排出的废水带有颜色,经鉴定含有铅。为了测定废水中铅的浓度,他设计了如下实验步骤:
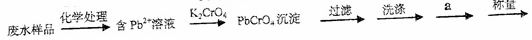
(1)步骤中过滤需要的玻璃仪器是 、 和烧杯。
(2)步骤中a操作称为 ,缺少此操作,测得结果 (填“偏高”、“偏低”、或“无影响”)。
19、已知某纯碱试样中含有NaCl杂质,为测定试样中纯碱的质量分数,可用下图中的装置进行实验。
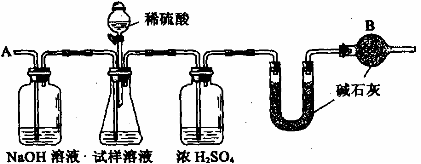
主要实验步骤如下:
①按图组装仪器,并检查装置的气密性
②将a g试样放入锥形瓶中,加适量蒸馏水溶解,得到试样溶液
③称量盛有碱石灰的U型管的质量,得到b g
④从分液漏斗滴入6mol·L-1的硫酸,直到不再产生气体时为止
⑤从导管A处缓缓鼓入一定量的空气
⑥再次称量盛有碱石灰的U型管的质量,得到c g
⑦重复步骤⑤和⑥的操作,直到U型管的质量基本不变,为d g
请填空和回答问题:
(1)在用托盘天平称量样品时,如果天平的指针向左偏转,说明
(2)装置中干燥管B的作用是
(3)如果将分液漏斗中的硫酸换成浓度相同的盐酸,测试的结果 (填高、偏低或不变)
(4)步骤⑤的目的是
(5)步骤⑦的目的是
(6)该试样中纯碱的质量分数的计算式为
(7)还可以用其他实验方法测定试样中纯碱的质量分数。请简述一种不同的实验法。
17、按要求完成以下小题
(1) 38.4mg的铜与适量浓硝酸反应,铜全部作用后。共收集到NO2和NO的混合气体22.4mL(标准状况),则混合气体中NO2和NO的体积之比为
,反应消耗硝酸的物质的量为
mol
(2)写出下列反应的离子方程式:
① 金属钠与水反应 

②Fe(NO3)3溶液中加入足量的HI溶液(氧化性:HNO3>
Fe3+ >I2)

(3)配平以下化学方程式,并用单线桥表示电子转移情况
Fe(OH)3 + NaClO+ NaOH = Na2FeO4 + NaCl + H2O
16、在标准状况下,进行甲、乙、丙三组实验:三组各取60mL 同浓度盐酸溶液,加入同一种镁铝合金粉末,产生气体,有关数据列表如下:

|
实验序号 |
甲 |
乙 |
丙 |
|
合金质量/mg |
510 |
770 |
918 |
|
气体体积/mL |
560 |
672 |
672 |

则下列说法正确的是

A.甲组和乙组的实验中,盐酸均是过量的


B.盐酸的物质的量浓度为0.8 mol·L―1 

C.合金中镁铝的物质的量之比为1∶1 

D.丙组中铝的物质的量为0.009 mol
株洲市二中2010届高三年级第三次月考
|
座位号 |
|
|
|
|
化学答卷
第Ⅰ卷选择题答案(每小题3分,共48分)
第Ⅱ卷
15、短周期的三种元素X、Y和Z,它们元素原子的最外层电子数分别为1、4、6。则这三种元素所组成的化合物得分子式不可能是
A:XYZ
B:X2YZ 
C:X2YZ2
D:X2YZ3
14、实验室有一瓶久置的白色K2SO3粉末,为确定其是否被氧化及其成分,元素分析表明粉末中K和S元素的质量比为39∶16,下列结论正确的是

A.根据元素分析结果推测该粉末为纯净物
B.将粉末溶于水,加入氯化钡,有白色沉淀生成,证明原粉末是K2SO4
C.将粉末加入盐酸中,产生气泡,证明原粉末是K2SO3
D.将粉末溶于水,加入氯化钡和过量的盐酸,有白色沉淀和气泡生成 ,证明原粉末是K2SO4和K2SO3的混合物 
13、某无色溶液中只可能含有Na+ 、Ba2 +、 Cl一、 Br一、SO32一、SO42一,对该溶液进行下列实验,实验操作和现象如下表: 
|
步骤 |
操 作 |
现 象 |
|
(1) |
取少量溶液滴加几滴石蕊试液 |
溶液变蓝 |
|
(2) |
另取少量溶液滴加过量氯水,再加入CCl4振荡,静置 |
上层无色,下层呈橙红色 |
|
(3) |
取(2)上层溶液,加入过量Ba(NO3)2溶液和稀HNO3,过滤 |
有白色沉淀产生 |
|
(4) |
向(3)的滤液中加入过量AgNO3溶液和稀HNO3 |
有白色沉淀产生 |
下列结论正确的是 
A.可能含有
Cl一、 SO32一、SO42一 B.肯定没有
Ba2 +、Cl一、Br一

C.不能确定 Na+ 、
SO32一、SO42一 D.肯定含有 Na+、 Br一、SO32一

湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com