
2、 下列几种主张体现古人构建和谐社会思想的有( ) 
①“己所不欲,勿施于人”②“兼爱,非攻”③“山林虽近,草木虽美,宫室必有度,禁伐必有时” ④“为政之要,惟在得人”
A、①②③ B、①②④ C、②③④ D、①③④ 
3 以下哪些是战国时期“重农抑商”政策产生的原因( ) 
① 封建的自给自足的自然经济

② 新兴地主阶级经济利益的反映

③ 封建社会初期不具备发展工商业的条件
④封建国家出于政治、军事需要的考虑
A、①②③ B、①②④ C、②③④ D、①②③④
1、 下列成语或典故出现的先后顺序是( ) 
①道路以目 ②围魏救赵 ③问鼎中原 ④退避三舍 A、 ①②③④ B、①③④② C、①④③② D、④③②① 
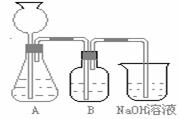
21.某活动课程小组拟用50mLNaOH溶液吸收CO2气体,制备Na2CO3溶液。为了防止通入的CO2气体过量生成NaHCO3,设计了如下实验步骤:
a.取25 mL NaOH溶液吸收过量的CO2气体,至CO2气体不再溶解;
b.小火煮沸溶液1-2 min;
c.在得到的溶液中加入另一半(25mL)NaOH溶液,使其充分混合反应。
(1)此方案能制得较纯净的Na2CO3,写出a、c两步的化学反应方程____________________、
 ____________________________。
____________________________。
此方案第一步的实验装置如下图所示:
(2)加入反应物前,如何检查整个装置的气密______________________________________。
(3)装置B中盛放的试剂是______________,作用是_______________________________。
(4)在实验室通常制法中,装置A还可作为下列_____________ 气体的发生装置(填序号)。
①CH2==CH2 ②H2S ③CH4 ④CH≡CH ⑤H2
(5)实验室制取下列气体:①NH3,②Cl2,③HCl,④H2S,⑤CH4, ⑥CO,⑦CO2,⑧O2时,属于必须进行尾气处理,并能用下图所示装置进行处理的,将气体的序号填入装置图的下方空格内。
(6)已知所用NaOH溶液中溶质的质量分数为40%,室温下该溶 液密度为1.44 g / mL,假设反应前后溶液的体积不变,不考虑实验误差,计算用此种方法制备所得Na2CO3溶液的物质的量
浓度为____________________。
20. A和B均为钠盐的水溶液,A呈中性,B呈碱性并具有氧化性。下述为相关实验步骤和实验现象:
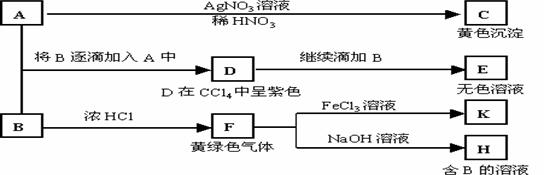

请回答:
(1)写出A、B和C的化学式:A
,B
,C
。
(2)依次写出A→D和D→E(E中含有某+5价元素的含氧酸根离子)的离子方程式:
,
。
(3)写出将SO2气体通入K溶液中发生反应的离子方程式:

(4)写出由F→H的化学方程式:
。
四 实验题(每空2分,共18分)
19.2008年5月12日四川汶川发生特大地震,为防止在大灾之后疫病流行,全国各地向灾区
运送了大量的各种消毒剂、漂白剂等。
(1)二氧化氯是目前国际上公认的第四代高效、无毒的广谱消毒剂,它可由KClO3在H2SO4存在下与Na2SO3 反应制得。请写出反应的离子方程式:
。
(2)过碳酸钠是一种有多用途的新型氧系固态漂白剂,化学式可表示为Na2CO3·3H2O2,它具有Na2CO3和H2O2的双重性质。过碳酸钠与下列物质均会发生化学反应而失效,其中过碳酸钠只发生了还原反应的是
。
A.MnO2 B.KMnO4溶液 C.稀盐酸 D.Na2SO3溶液
(3)漂白剂亚氯酸钠(NaClO2)在常温与黑暗处可保存一年,亚氯酸不稳定可分解,反应的离子方程式为:HClO2 → ClO2↑+ H+
+Cl-+H2O(未配平)。当1 mol HClO2发生分解反应时,转移的电子个数是
。
(4)有Fe2+、NO3-、Fe3+、NH4+、H+和H2O六种粒子,分别属于同一氧化还原反应中的反应物和生成物,则该反应中还原剂与氧化剂的物质的量之比为
。
三 推断题(每空2分,共14分)
18.有一瓶澄清透明溶液,可能含有NH4+、Fe2+、Fe3+、Ba2+、Al3+、SO42-、HCO3-、NO3-、C1-中的一种或几种。取该溶液进行以下实验:
(1)
溶液滴在蓝色石蕊试纸上,试纸呈红色;
(2)
取部分溶液浓缩后加入铜片和浓硫酸共热,有红棕色气体生成;
(3)
取少量溶液,加入硝酸酸化的氯化钡溶液,产生白色沉淀;
(4)
将(3)中的沉淀滤出,滤液中加入硝酸银溶液,生成白色沉淀;
(5)
另取部分溶液,逐滴加入稀NaOH溶液,使溶液从酸性逐渐转变为碱性,在滴加过程先看到生成沉淀,随之沉淀部分溶解,并呈红褐色。
根据上述实验事实确定:在该溶液中肯定存在的离子是
,肯定不存在的离子是
,不能确定是否存在的离子
是
。 
17.实验室为监测空气中汞蒸气的含量;往往悬挂涂有CuI的滤纸,根据滤纸是否变色颜色发生变化所用去的时间来判断空气中的含汞量,其反应为:4CuI+Hg→Cu2HgI4+2Cu
(1)上述反应产物Cu2HgI4中,Cu元素显 价。
(2) 以上反应中的氧化剂为
,当有1molCuI参与反应时,转移电子
___________mol。
(3)CuI可由Cu2+与I-直接反应制得,请配平下列反应的离子方程式,并标出电子转移方向和数目。
Cu2++ I-- CuI + I3-
16.从手册上查得: H - H、Cl - Cl和 H - Cl的键能分别为+ 436 kJ·mol-1、+243 kJ·mol-1和+ 431 kJ·mol-1,请用此数据估计,由Cl2 、H2生成 1mo l H-Cl 时
(吸收或放出)热量,反应热化学方程式为
。
15.向某FeBr2溶液中,通入1.12L(标准状况下)的Cl2,测得溶液中c(Br-)=3c(Cl-)=0.3mol/L。
反应过程中溶液的体积变化不计,则下列说法中正确的是

A.原溶液的浓度为0.1mol/L B.反应后溶液中c(Fe3+)=0.1mol/L
C.反应后溶液中c(Fe3+)=c(Fe2+) D.原溶液中c(Br-)=0.4mol/L
第Ⅱ卷 非选择题(共55分)
14.已知KOCN中碳为+4价,在KOCN + KOH + Cl2 → CO2
+ N2 + KCl + H2O
反应中,如果有6 
mol Cl2 完全反应,则被氧化的KOCN的物质的量是 ( )
A.2 mol B.3
mol
C.4 mol D. 6
mol
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com