
4.设m,n是两条不同的直线, 是三个不同的平面,给出下列四个命题:
是三个不同的平面,给出下列四个命题:
(1)若 ; (2)若
; (2)若 ;
;
(3)若 ; (4)若
; (4)若
A.(1)和(2) B.(2)和(3) C.(3)和(4) D.(1)和(4)
2.“函数 存在反函数”是“函数
存在反函数”是“函数 上为增函数”的 ( )
上为增函数”的 ( )
A.充分不必要条件 B.必要不充分条件
C.充分必要条件 D.既不充分也不必要条件
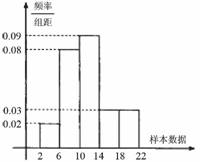 3.样本容量为200的频率分布直方图如图所示,
3.样本容量为200的频率分布直方图如图所示,
根据样本的频率分布直方图估计,数据落
在 内的概率约为
( )
内的概率约为
( )
A.0.10
B.0.20
C.0.30
D.0.40
1.设集合 等于 ( )
等于 ( )
A. B.
B.
C. D.
D.
31.(22分)某单子叶植物的非糯性(B)对糯性(b)为显性,抗病(R)对不抗病(r)为显性,花粉粒长形(D)对圆形(d)为显性,三对等位基因分别位于三对同源染色体上。用碘液对花粉染色,非糯性呈蓝色,糯性呈棕色。现提供以下四种纯合亲本:
|
亲本 |
性 状 |
|
甲 乙 丙 丁 |
非糯性 抗病 花粉粒长形 非糯性 不抗病 花粉粒圆形 糯性 抗病 花粉粒圆形 糯性 不抗病 花粉粒长形 |
(1)通过鉴定花粉形状验证基因的分离定律,可选择亲本甲与亲本 杂交。
(2)通过鉴定花粉性状验证基因的自由组合定律,杂交时选择的亲本组合是 。
将该杂交组合所得F1的花粉涂在载玻片上,加碘液染色,置于显微镜下观察,统计不同性状花粉粒的数目,预期花粉粒的类型及理论比例为: 。
(3)丙与丁杂交,其F1的表现型是 。F1自交得F2,不考虑基因突变、交叉互换等情况,F2共有 种表现型,各表现型的理论比例为 ;F2中与F1表现相同的纯合体占 。
(4)杂交组合甲和乙、甲和丙、乙和丙中,F2出现非糯性、抗病、花粉粒圆形植株比例最高的亲本组合是 ,该杂交组合的两亲本基因型分别是 。在该组合产生的F2中,表现型为糯性、抗病、花粉粒圆形的植株中,能稳定遗传的个体所占的比例是 。
30.(20分)下表是甲、乙两名中年男子的血检化验单的部分数据(单位:mg/dL),请根据所学的知识分析回答问题。
|
项目 |
甲 |
乙 |
正常值 |
|
血糖 |
185 |
85 |
80~120 |
|
甘油三酯 |
180 |
130 |
10~150 |
|
总胆固醇 |
300 |
200 |
100~250 |
|
血红蛋白 |
1.4×104 |
0.8×104 |
1.2~1.6×104 |
(1)从表中甲所具有的数据判断,当血糖含量高于 范围时,会出现尿糖,他可能患有糖尿病;若他肝脏功能不好,或 等合成减少时,造成 的合成受阻,易形成脂肪肝。
(2)糖尿病患者在注射超过所需含量的胰岛素后,会出现四肢无力,活动减少,甚至昏迷等低血糖症状。胰岛素对血糖的调节作用可通过促进血糖进入 、 等组织细胞合成糖元、氧化分解或 等途径降低血糖浓度。
(3)神经系统对血糖的调节作用主要是通过 和有关神经控制相关激素的分泌来实现的。
(4)乙想去西藏旅游,根据他的检查结果,你是否赞成? 。理由是:
。
(5)镰刀型细胞贫血症患者与正常人相比,其血红蛋白分子的一条多肽链上氨基酸的
(种类/数量)不同。
29.(18分)
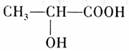 乳酸是人体生理活动中的一种代谢产物,近年来已成为人们研究的热点之一,其结
乳酸是人体生理活动中的一种代谢产物,近年来已成为人们研究的热点之一,其结
构简式为:
下图是采用化学方法对乳酸进行加工处理的过程:
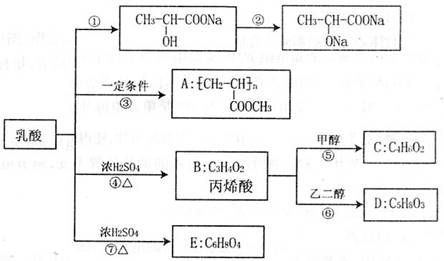
请回答有关问题:
(1)实验变化过程①和②时依次加入的试剂是 、 。
(2)完成转化③时所涉及的主要反应有三步,写出反应的化学方程式及其反应类型:
,反应类型: ;
,反应类型: ;
,反应类型: ;
(3)化合物C的名称为 (填序号)。
a.丙酸甲酯 b.甲酸丙烯酯 c.丙烯酸甲酯
(4)写出化合物D和E的结构简式:D 、E 。
28.(12分)
I.中学化学教材中介绍了NH3的实验室制法,反应的化学方程式为 ,请从下图中选择制取装置: (填序号,下同),如果用D装置收集NH3,气体应从 口进入。
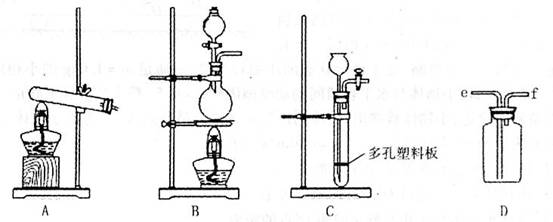
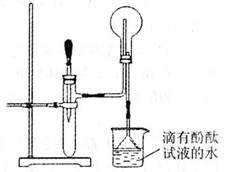 II.右图是某化学兴趣小组的同学设计的制取NH3
II.右图是某化学兴趣小组的同学设计的制取NH3
并进行NH3性质实验的改进装置。他们先称
取mg固体氯化铵放入试管底部,再快速称取
ng氢氧化钠固体盖在氯化铵表面,立即用带
滴管的胶塞塞紧试管(滴管内事先吸入一定体
积的浓氨水),慢慢挤压胶头滴管,立即看到
试管内产生大量气泡。请回答有关问题:
(1)该化学兴趣小组的同学对用此装置制取NH3的
原理进行了分析,你认为合理的是(填序号):
;

 ①浓氨水中存在平衡:NH3+H2O NH3·H2O NH+4+OH-,NaOH使平衡向左移动;
①浓氨水中存在平衡:NH3+H2O NH3·H2O NH+4+OH-,NaOH使平衡向左移动;

 ②浓氨水中存在平衡:NH3+H2O NH3·H2O NH+4+OH-,NH4Cl使平衡向左移动;
②浓氨水中存在平衡:NH3+H2O NH3·H2O NH+4+OH-,NH4Cl使平衡向左移动;
③NaOH溶于水时放热,温度升高,NH3的溶解度减小,有部分NH3逸出;
④NH4Cl和NaOH在此条件下反应,生成NH3。
(2)简述判断图中烧瓶内收满NH3的现象: ;
(3)该实验还能证明NH3的什么性质? 。
27.(16分)铝、铁和氯是三种运用广泛的元素。
(1)写出FeCl3溶液腐蚀印刷电路铜板的离子方程式 ,若将此反应设计成原电池,写出电极反应式:正极反应 ,负极反应 。
(2)工业上用电解饱和食盐水的方法制取氯气,制得的氯气与另一电解产物在一定条件下反应生成两种盐A和B,其物质的量比为5:1,则盐A和B的化学式依次为
,盐B在酸性条件下可与草酸(H2C2O4)反应制得气体ClO2,写出该反应的离子方程式: ,ClO2是当前对饮用水进行消毒的一种高效消毒剂,物质的量相等的ClO2和Cl2相比较,ClO2的消毒杀菌能力是Cl2的 倍。
(3)生产中常用铝热反应焊接钢轨,反应的化学方程式为 ;同温同压下,在浓度均为2mol/L,体积均为100mL的盐酸和NaOH溶液中分别加入等质量的铝,产生气体的体积比为5:6,则加入铝的质量为 g。
26.(14分)A、B、C、D、E、F六种物质的相互转化关系右如图所示:
(1)若A是常见的金属单质,能与B的水
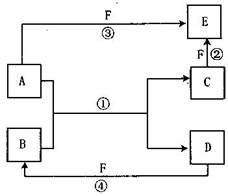 溶液反应生成C和D,D、F是气体
溶液反应生成C和D,D、F是气体
单质。则A元素在元素周期表中的
位置为 ,反应②的离子
方程式为 。
(2)若A、D、F都是非金属单质,且A、
D所含元素同主族,A、F所含元素
同周期,则物质B的化学式为 ,
物质E的电子式为 ,
B和E在固态时分别属于 晶体
和 晶体。
(3)若A为Mg,D为一种常见非金属单质,且③④两个反应都有红棕色气体产生,则反应①和④的化学方程式分别为:
① ;
④ 。
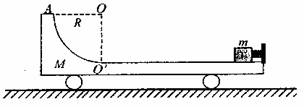
25.(20分)如图所示,光滑水平面上有一质量M=4.0kg的平板车,车的上表面右侧是一段长L=1.0m的水平轨道,水平轨道左侧是一半径R=0.25m的1/4光滑圆弧轨道,圆弧轨道与水平轨道在O′点相切。车右端固定一个尺寸可以忽略,处于锁定状态的压缩轻弹簧,一质量m=1.0kg的小物体(可视为质点)紧靠弹簧,小物体与水平轨道间的动摩擦因数 。整个装置处于静止状态。现将轻弹簧解除锁定,小物体被弹出,恰能到达圆弧轨道的最高点A。不考虑小物体与轻弹簧碰撞时的能量损失,不计空气阻力。g取10m/s2,求:
。整个装置处于静止状态。现将轻弹簧解除锁定,小物体被弹出,恰能到达圆弧轨道的最高点A。不考虑小物体与轻弹簧碰撞时的能量损失,不计空气阻力。g取10m/s2,求:
(1)解除锁定前轻弹簧的弹性势能
(2)小物体第二次经过O′点时的速度大小
(3)最终小物体与车相对静止时距O′点的距离。
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com