
13、下列叙述符合史实的是
A.相对论时空观认为长度、质量、时间都是绝对不变的
B.牛顿发现了万有引力定律,卡文迪许第一次在实验室测定了万有引力常量,卡文迪许也因此被誉为“能测量地球质量的人”
C.爱因斯坦提出了量子理论,后来普朗克用光电效应实验提出了光子说
D.牛顿应用“理想斜面实验”推翻了亚里士多德的“力是维持物体运动的原因”观点
28、(14分)黄铁矿(主要成分为FeS2)是我国大多数硫酸厂制取硫酸的主要原料。某化学学习小组对某黄铁矿石进行如下实验探究。
[实验一]测定硫元素的含量。
 Ⅰ、将m1 g该黄铁矿样品放入如图所示装置(夹持和加热装置省略)的石英管中,从a处不断地缓缓通入空气,高温灼烧石英管中的黄铁矿样品至反应完全。石英管中发生反应的化学方程式为:4FeS2 + 11O2 2Fe2O3
+ 8SO2
Ⅰ、将m1 g该黄铁矿样品放入如图所示装置(夹持和加热装置省略)的石英管中,从a处不断地缓缓通入空气,高温灼烧石英管中的黄铁矿样品至反应完全。石英管中发生反应的化学方程式为:4FeS2 + 11O2 2Fe2O3
+ 8SO2
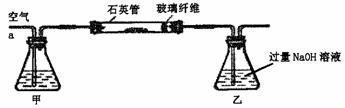
Ⅱ、反应结束后,将乙瓶中的溶液进行如下处理:
|
 III、测定铁元素含量的实验步骤如图所示。
III、测定铁元素含量的实验步骤如图所示。
问题讨论:
(1)I中,甲瓶内所盛试剂是 ________溶液。乙瓶内发生反应的离子方程式有______
________溶液。乙瓶内发生反应的离子方程式有______
___________。
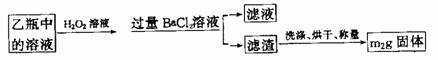
(2)II中,所加H2O2溶液(氧化剂)需足量的理由是__________。
(3)该黄铁矿中硫元素的质量分数为__________。
(4)III的步骤②中,若选用铁粉作还原剂,你认为合理吗?_______,理由是:_______。
(5)III的步骤③中,需要用到的仪器除烧杯、玻璃棒、胶头滴管外,还有_________。

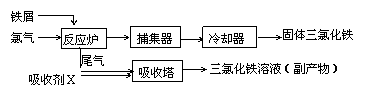
27、(14分)氯化铁是常见的水处理剂,无水FeCl3的熔点为555K、沸点为588K。工业上制备无水FeCl3的一种工艺如图所示。
(1)取0.5mL三氯化铁溶液滴入50mL沸水 中,再煮沸片刻得红褐色透明液体,该过程可用离子方程式表示为____________。
中,再煮沸片刻得红褐色透明液体,该过程可用离子方程式表示为____________。
(2)下表是六水合氯化铁在水中的溶解度。
六水合氯化铁的溶解度
|
温度/℃ |
0 |
10 |
20 |
30 |
50 |
80 |
100 |
|
溶解度 /(g/100g H2O) |
74.4 |
81.9 |
91.8 |
106.8 |
315.1 |
525.8 |
535.7 |
从FeCl3溶液中获得FeCl3·6H2O的方法是_______________。
(3)捕集器中温度超过673K,存在相对分子质量为325的物质,该物质的分子式为:______
(4)吸收剂X是________;吸收塔中吸收剂X的作用是________。
(5)FeCl3的质量分数通常可用碘量法测定:称取m g无水氯化铁样品,溶于稀盐酸,再转移到100mL容量瓶,用蒸馏水定容;取出10.00 mL,加入稍过量的KI溶液,充分反应后,用淀粉作指示剂并用c mol/L Na2S2O3溶液滴定(I2+2S2O32- = 2I- + S4O62-),共用去V mL.则样品中氯化铁的质量分数为____________。
13、下列实验中,“操作和现象”与“结论”对应关系正确的是( )
|
|
操作和现象 |
结论 |
|
A |
向纯碱粉末中滴加足量浓盐酸,将产生的气体通入苯酚钠溶液,溶液变浑浊 |
酸性:盐酸>碳酸>苯酚 |
|
B |
取某溶液少量,加入盐酸酸化的氯化钡溶液,出现白色沉淀 |
该溶液中一定含有SO42- |
|
C |
取少量Fe(NO3)2试样加水溶解,加稀硫酸酸化,滴加KSCN溶液,溶液变为红色 |
该Fe(NO3)2试样已经变质 |
|
D |
取皂化反应后的混合液滴入盛水的烧杯中,出现油滴 |
皂化反应不完全 |
12、常温下,下列各溶液的叙述不正确的是( )
A、pH=7 的醋酸钠和醋酸混合液中:c(Na+)= c(CH3COO-)
B、0.1 mol/L的醋酸的pH=a , 0.01mol/L的醋酸的pH=b, 则a+1 > b
C、0.1 mol/L的醋酸钠溶液20mL与0.1mol/L的盐酸10mL混合后溶液显酸性:
2c(H+) + c(CH3COOH) = c(CH3COO-) + 2c (OH-)
D、已知酸性HF > CH3COOH, pH相等的NaF与CH3COOK溶液中,
[ c(Na+ )-c(F- )]<[c(K+)-c(CH3COO- )]
11、下列各组物质间反应可能包括多步反应,其总的离子方程式正确的是( )
A、NaClO溶液中通入过量SO2:ClO- + SO2 + H2O == HClO + HSO3-
 B、AlCl3 溶液中投入过量Na:Al3+ + 4Na + 2H2O
== AlO2- + 4Na+ + 2H2↑
B、AlCl3 溶液中投入过量Na:Al3+ + 4Na + 2H2O
== AlO2- + 4Na+ + 2H2↑
C、FeBr2溶液中通入少量Cl2:2Fe2+ + 4Br- + 3Cl2 == 2 Fe3+ + 2 Br2 + 6Cl-
D、向明矾溶液中滴加Ba(OH)2,恰好使SO42-沉淀完全:
2Al3+ + 3SO42- + 3Ba2+ + 6OH- = 2Al(OH)3↓+ 3BaSO4↓
10、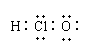 正确掌握好化学用语是学好化学的基础,下列有关表述正确的是( )
正确掌握好化学用语是学好化学的基础,下列有关表述正确的是( )
A、次氯酸的电子式 B、质量数为16的氧原子:168 O
C、乙炔的结构简式:H-C≡C-H
D、P4、CH4、NH4+ 粒子的空间构型均为正四面体型;CO2、C2H2均为直线型分子
9、 镁及其化合物一般无毒(或低毒)、无污染,镁电池放电时电压高且平稳,因而越来越成为人们研制绿色电池所关注的重点。有一种镁二次电池的反应为:( )
镁及其化合物一般无毒(或低毒)、无污染,镁电池放电时电压高且平稳,因而越来越成为人们研制绿色电池所关注的重点。有一种镁二次电池的反应为:( )
xMg +MO3S4 M gxMO3S4 下列说法错误的是
gxMO3S4 下列说法错误的是
A、放电时Mg2+ 向正极迁移
B、放电时正极的电极反应为MO3S4 + 2xe- == MO3S42x-
C、放电时MO3S4发生氧化反应
D、充电时阴极的电极反应为xMg2+ + 2xe- == x Mg
8、设NA为阿伏加德罗常数的值,下列有关叙述正确的是( )
A、28g乙烯和28g丙烯中均含有6NA对共用电子对
B、在熔融状态下,1 mol NaHSO4完全电离出的阳离子数为2NA
C、7.8g Na2O2含有的阴离子数目为0.2NA
D、分别处于第二、三周期的两种元素的原子各1 mol,其最外层电子数最多相差8 NA
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com