
4.史学家修昔底德在《伯罗奔尼撒战争史》中写下了“男人就是城邦”之句。根据雅典民主政治的特点,以下解释最确切的是 ( )
A.妇女地位低下,属于奴隶阶层,无权参政
B.全体男性皆为公民,他们拥有国家管理的权利
C.男性公民共同分享城邦的权力,承担社会义务
D.男人参军,保家卫国,确保了雅典城邦的安全
3.下表是我国古代某地的居民职业结构表。该表格 ( )
|
|
自耕农和地主 |
佃农 |
手工工场主和雇主 |
商人 |
|
占总人口比例 |
24% |
36% |
30% |
10% |
①可用于研究唐宋时期的经济发展状况 ②表明手工业经营方式出现了新的动向
③体现出商品经济的新发展 ④官营手工业退居次要地位
A.①② B.②③ C.①③ D.②④
2.《宋史》中出现了一些人名,如焦守节(卷261)、李克让(卷270)、陈从信(卷277)、赵安仁(卷287)、钱端礼(卷385)、张忠恕(卷409)等,从中可以推测下哪种思潮影响了当时人的取名。 ( )
A.佛教思想 B.道家思想 C.法家思想 D.程朱理学
1.有人在评述秦朝的政治变革时说:“这是一个划时代的突破和最骇人听闻的政治结构,没有封国封爵,没有公侯伯子男。当时没有一个人敢于想象皇帝的儿子们竟会跟平民一样,竟没有拥有土地,更没有拥有奴隶群。尤其是崇古的儒家学派的学者,面对着这么大的巨变,大惑不解。”儒家学派的学者“大惑不解”是因为“巨变” ( )
A.削弱了宗法制的作用 B.缺乏应有的理论基础
C.加剧了地主阶级内部的矛盾 D.加速了秦朝的灭亡
(二)选考题:共15分,请考生从给出的“物质结构与性质、有机化学基础”中任选一题做答。如果多做,则按所做的第一题计分。
11.[选修物质结构与性质](15分)
 A、B、C、D、E、F为六种短周期元素,它们核电荷数依次递增。已知:B原子核外最外层电子数是次外层电子数的两倍,电子总数是E原子总数的1/2,F是同周期元素中原子半径最小的元素;D2-与E2+的电子层结构相同。B与D可以形成三原子化合物甲。A是非金属元素,且A、C、F可形成离子化合物乙。请回答:
A、B、C、D、E、F为六种短周期元素,它们核电荷数依次递增。已知:B原子核外最外层电子数是次外层电子数的两倍,电子总数是E原子总数的1/2,F是同周期元素中原子半径最小的元素;D2-与E2+的电子层结构相同。B与D可以形成三原子化合物甲。A是非金属元素,且A、C、F可形成离子化合物乙。请回答:
(1)C单质的电子式 ,F元素原子的电子排布式 ,
E元素的原子结构示意图是 。
(2)化合物乙中含有的化学键是 。
(3)化合物甲为固体时属于 晶体,E单质在一定条件
下与甲反应的化学方程式为 。
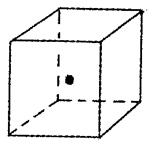
(4)如图立方体中心的“·”表示B单质所形成的原子晶体中
的一个原子,请在立方体的顶点用“·”表示出与之紧邻
的B原子
12.[选修有机化学基础](15分)
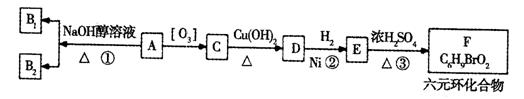
某研究人员发现一个破裂的小瓶中渗漏出一未知有机物A,有催泪作用。经分析A的相对分子质量为161,该化合物中除含有C、H元素外还含有一种卤族元素,且分子中只含有一个甲基。化合物A-F的转化关系如下图所示,其中1molC与足量的新制Cu(OH)2溶液反应可生成1molD和1mol Cu2O,B1和B2均为较稳定的化合物且互为同分异构体。
已知(1)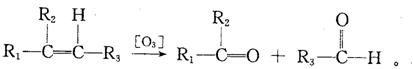
(2)一个碳原子上连有两个碳碳双键的结构(-C=C= C-)不稳定。
请完成下列问题:
(1)化合物A含有的官能团是____。B1的相对分子质量是 。
(2)④、②、③的反应类型分别是 、 、 。
(3)写出A、F的结构简式:A____;F 。
(4)写出C→D反应的化学方程式: 。
(一)必考题(3题,共43分)
8.(13分)某研究性学习小组的一个课题是“NO2能否支持木条的燃烧?”由于实验室中没有现成的NO2气体,该小组的同学设计了两个方案(忽略N2O4的存在,图中铁架台等夹持仪器均已略去):
I.实验装置如下图l所示
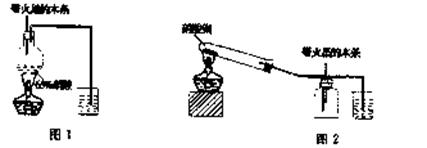
(1)浓硝酸受热分解的化学方程式是 。
(2)实验开始后木条上的火星逐渐熄灭,有的同学得出“NO2不能支持木条的燃烧”的结论。你认为这一结论是否正确?--(填“正确,,或“不正确),理由是
。
Ⅱ.实验装置如上图2所示
(1)硝酸铜固体加热分解的产物有氧化铜、二氧化氮和氧气,该反应的化学方程式是
。
(2)当集气瓶中充满红棕色气体时,木条复燃了,有的同学得出“NO2能支持木条的燃烧”的结论。你认为这一结论是否正确? (填“正确”或“不正确”),理由是_ ___。
III.为了更直接说明“NO2能否支持木条的燃烧”这一问题,请你重新设计一个简单的实验方案,简述实验原理和主要操作。
9.(13分)已知甲、乙、丙分别代表中学化学中的常见物质,请根据题目要求回答下列问题:
(1)若甲的化学式为RCl3,其溶液在加热蒸于并灼烧时可发生如下反应:
a.甲+H2O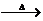 乙十丙 b.乙
乙十丙 b.乙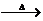 氧化物+H2O
氧化物+H2O
①若甲为某用途广泛的金属元素的氯化物,其溶液在上述变化中生成的氧化物为红 棕色粉末,则该金属在周期表中的位置是: 。
②若甲为某短周期金属元素的氯化物,则甲发生a反应的化学方程式为:____。
③将以上两种金属单质用导线连接,插入一个盛有NaOH溶液的烧杯中构成原电池,则负极发生的电极反应为 。
(2)若甲、乙、丙均是短周期中同一周期元素形成的单质或化合物,常温下乙为固体单质,甲和丙均为气态化合物,且可发生反应:甲十乙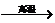 丙。则:
丙。则:
①甲的结构式为 。
②写出上述反应的化学方程式 。
③写出在200mL 2mol/L的NaOH溶液中通入6.72L(标准状况)的气体甲发生完全反应的总离子方程式 。
10. (17分)利用催化氧化反应将SO2转化为SO3是工业上
(17分)利用催化氧化反应将SO2转化为SO3是工业上
生产硫酸的关键步骤。
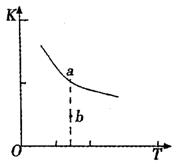
(1)某温度下,2SO2(g)+O2(g)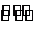 2S03(g)
2S03(g)
△H3=mkJ/mol,平衡常数(K)的大小与温度
(T)的关系如右图中曲线所示,则m____0
(填“>”“=”或“<”);
b点时v(正) v(逆)(填“<”、“=”或“>”)。
反应的焓变(△H)将 (填“增大”、“减小”
或“不变”)。
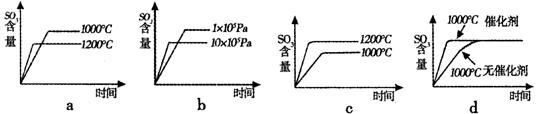
(2)若反应物起始的物质的量相同,下列关系图不正确的是 (填序号)。
(3)某硫酸厂利用SO2尾气、废铁屑、空气、水合成绿矾(FeS04·7H2O),反应中作还原剂的物质是 。
(4)将反应后的混合气体用氨水吸收可得到(NH4)2SO3和(NH4)2SO4两种化工原料。
①对于(NH4)2SO3溶液,某同学写出了如下的正确关系式:
2[c(SO2-3)十c(HSO-3)+c(H2SO3)]=c(NH+4)+c(NH3·H2O)
请分析该同学的依据是 。
②在(NH4)2 SO4溶液中存在:NH+4+ H2O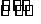 NH3·H2O+H+,则该反应常温下的平衡常数K= (已知:常温下,NH3·H2O的电离平衡常数K=1.7×10-5)
NH3·H2O+H+,则该反应常温下的平衡常数K= (已知:常温下,NH3·H2O的电离平衡常数K=1.7×10-5)
(5)三氧化硫吸收后所得的硫酸常用来制备BaSO4作X射线透视时的内服造影剂,胃酸很强(pH约为1),但服用大量BaSO4仍然是安全的,BaSO4不溶于酸的原因是(用溶解平衡原理解释) 。万一误服了少量BaCO4,应尽快用大量0. 5mol/LNa2SO4溶液给患者洗胃,如果忽略洗胃过程中Na2SO4溶液浓度的变化,残留在胃液中的Ba2+浓度仅为mol/L(已知25℃时,Ksp(BaSO4)=1×l0-10 ,Ksp(BaCO3)=1×10-9).
7.将15.6 g Naz02和5.4 g A1同时放入一定量的水中,充分反应后得到200 mL溶液,再向溶液中缓慢通入标准状况下的HCl气体6.72 L,若反应过程中溶液的袜积保持不变,则下列说法正确的是 ( )
A.最终得到7.8g沉淀
B.最终得到的溶液中只含NaCl溶质
C.最终得到的溶液中c(Na+)=1.5mO1/L
D.标准状况下,反应过程中得到6.72L的气体
6.25℃时,在25 mL 0.1 mol/L的NaOH溶液中,逐滴加入0.2 mol/L的CH3COOH溶液,溶液的pH与醋酸体积关系如右图,下列分析正确的是 ( )
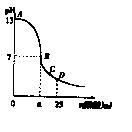 A.B点的横坐标a=12.5
A.B点的横坐标a=12.5
B.C点时溶液中有:
c(Na+)>c(CH3COO-)>c(H+)>c(OH-)
C.D点时溶液中有:
c(CH3COO-)+c(CH3COOH)=2c(Na+)
D.曲线上A、B间的任意一点,溶液中都有:
c(CH3COO-)>c(Na+)>c(OH-)>c(H+)
5.下列关于热化学反应的描述中正确的是 ( )
A.需要加热才能发生的反应一定是吸热反应
B.1mol硫燃烧生成气态三氧化硫所放出的热量是硫磺的燃烧热
C.HCl和NaOH反应的中和热△H=-57.3kJ/mol,则H2SO4Ca(OH)2反应的中和热为2×(-57.3)kJ/mol
D.CO(g)的燃烧热是283.0kJ/tool,则表示CO燃烧热的热化学方程为
CO(g)+1/2O2(g)===CO2(g) △H=-283.0kJ/mol
4.下列离子方程式书写正确的是 ( )
A.盐酸滴人氨水中:H++OH-一H2O
B.过量的SO2通人NaOH溶液中:SO2+20H-=SO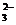 十H2O
十H2O
C.Fe(NO2)2溶液中加入过量的HI溶液:2Fe3++2I-=2Fe2++2H2O
D.硫酸亚铁溶液与稀硫酸、双氧水混合:2Fe2++H2O2+2H+=2Fe3++2H2O
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com