
2.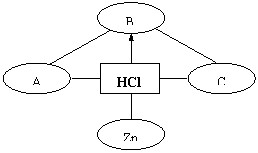
 (2008年宜昌市)构建知识网络是一种重要的学习方法。下图是关于盐酸化学性质的知识网络,“--”表示相连的两种物质能发生反应,“
”表示一种物质转化成另一种物质,A、C属于不同类别
的化合物。完善这个知识网络:
(2008年宜昌市)构建知识网络是一种重要的学习方法。下图是关于盐酸化学性质的知识网络,“--”表示相连的两种物质能发生反应,“
”表示一种物质转化成另一种物质,A、C属于不同类别
的化合物。完善这个知识网络:
(1) 写出A、B、C的化学式:
A ;B ;C 。
(2) 根据自己得出的知识网络写出
一个复分解反应化学方程式:
1.(200 8年河北省)A-H都是初中化学中的常见物质,它们之间的转化关系如图14所示。A是天然气的主要成分,E是一种常见的食品干燥剂。
请回答:
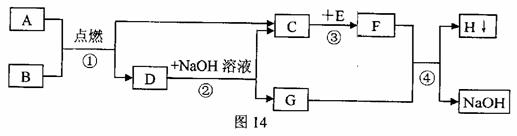
(1)A的化学式为 ;
(2)反应③的基本反应类型是 ;
(3)反应②的化学方程式为 ;
反应④的化学方程式为 。
4.发散思维各个击破 例4.(2008年泰安市)今年年初,我国南方出现了大面积的冰雪灾害,在
除雪过程中,融雪剂发挥了很大的作用。某公司生产的融雪剂是由氯化钠、硝酸钠、氯化镁、硫酸铜中的两种或两种以上的物质组成的。小佳同学为探究其成分,设计并完成了以下实验:
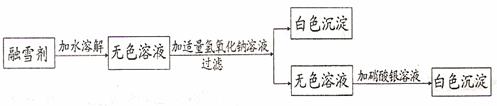
请你根据以上设计过程,完成下列空白:
(1)该融雪剂中一定含有 (写化学式,下同),一定不含有 ,可能含有 ;
(2)加入硝酸银溶液发生反应的化学方程式是 。
练习4:(08年广东省肇庆市中考化学题)(8分)实验结束时,同学们将含有CuSO4、ZnSO4、FeSO4的废液倒在废液缸里,如果将废液直接排放就会造成水污染。于是几位同学利用课余处理废液,回收工业重要原料硫酸锌和有关金属。实验过程如下:
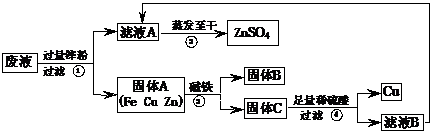
请回答:
(1)滤液A和滤液B含有相同的溶质,其名称是 ;固体B的化学式为 。
(2)写出步骤①其中一个反应的化学方程式 ;
步骤④发生反应的化学方程式为 。
(3)要检验步骤④中加入的稀硫酸是否足量的方法是
。
(4)若实验过程中的物质损失可以忽略,要计算该废液中硫酸锌的质量分数,必须称量:废液的质量和 。
3、提出假设 逐一论证
例3 、(株州市)有X、Y、Z三种常见化合物,它们之间有如下转化关系: ① X+2Y=Z+H2O;②Z+Ca(OH)2=CaCO3↓+2Y。试推断(用化学式回答): (1)X是__。 (2)符合上述条件的Y、Z有多少种组合,请任意写出一种组合:Y是__;Z是_
___。
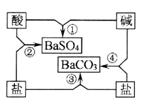 练习3、(08年广东省汕头市中考化学题) (10分)右图是常见酸、碱、盐之间的相互转化关系。
练习3、(08年广东省汕头市中考化学题) (10分)右图是常见酸、碱、盐之间的相互转化关系。
(1) 写出图中相应物质的化学式:酸 、碱 。
(2)写出图中反应②和④的化学方程式:
②
④
(3)总结化学反应的规律是我们学习化学的方法之一。请根据
上图总结出酸、碱、盐相互反应的规律(写2点) 、
。
例1、已知:A、B、C、D、E、F六种物质之间存在如下关系:
①A+B→C+H2O
②C+KOH→D↓(蓝色)+E
③B+D→C+H2O
④E+BaCl2→F↓+KCl (F:白色,不溶于稀硝酸)
根据上述转化关系,推断有关物质的化学式:
A. __________,B. __________,C. __________。
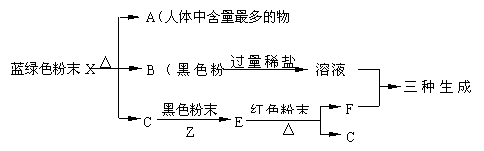 练习1、(08年广东佛山中考题)(5分)小明用实验室一瓶蓝绿色粉末X进行了以下实验:
练习1、(08年广东佛山中考题)(5分)小明用实验室一瓶蓝绿色粉末X进行了以下实验:
(1)A为________,红色粉末Y为_________。(均填化学式)
(2)蓝绿色粉末X受热分解的化学反应方程式为:X 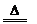 A + 2B + C。根据推理判断A、B、C三种物质均含有____元素(写元素名称),一个X分子中含有该元素的原子个数为
个。
A + 2B + C。根据推理判断A、B、C三种物质均含有____元素(写元素名称),一个X分子中含有该元素的原子个数为
个。
(3)溶液D与F反应的化学方程式:
。
2.、逆向思维 反向推断 例2、 X是两种金属氧化物组成的混合物,为了研究混合物的成分,进行了如图所
示的实验。
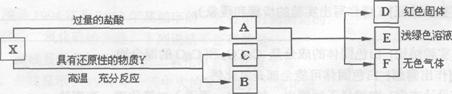
(1)x中含有的金属元素是 ______(填元素符号)。
(2)写出X中一种成分与盐酸反应的化学方程式:_________。
(3)若Y为固体,写出Y与X中一种成分反应的化学方程式 ______________;若Y为气体,Y还可以是__________(填化学式)。
练习2:(08年广东省梅洲市中考题)(9分)A、B、C、D、E、F、H、I、M为初中化学常见的物质,且有下图所示的转化关系。已知A、B含有相同的元素,B、D、H、M为氧 化物,C、E为单质,反应②是实验室检验气体H的反应。请回答:
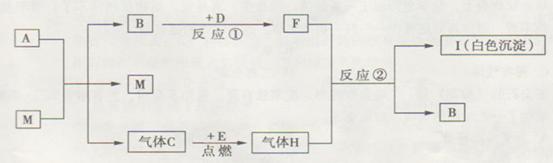
(1)A、M的化学式分别是_________、__________;M的作用是_______________。
(2)写出反应①、②的化学方程式:
反应①____________________________;反应②_______________________________。
(3)实验室检验集气瓶内气体C的方法是________________________________________。
1、文字叙述型;2、方程式叙述型;3、框图型;4、连线型;5、表格型。
1、找到突破口进行联想;2、在训练中找感觉。
14、化学课外活动小组的同学对某炼铁厂生产的生铁(杂质不与酸反应)进行组成分析。其实验数据如下表:
|
实验步骤 |
数据 |
|
1、称取生铁样品放入烧杯中 |
14.5克 |
|
2、加入足量15%盐酸 |
200.0克 |
|
3、称量反应后烧杯中物质总质量 |
214.0克 |
根据表中数据,计算生铁的纯度。(精确到0.001)
13、用20克的KmnO4加热制氧气,制得所需氧气后,停止加热,称取剩余固体质量为18.72克。问:
①制取氧气多少克?
②消耗了多少克的KmnO4?
③KmnO4分解的百分率是多少?
12、足量的铁与245克稀H2SO4反应,生成H2的质量是多少?计算此题时,除题中所给数据必须使用外,还缺少一个 的数据。若用a表示此数据,则生成的质量为 。
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com