
6.(2001上海,3)a=3是直线ax+2y+3a=0和直线3x+(a-1)y=a-7平行且不重合的( )
A.充分非必要条件 B.必要非充分条件
C.充要条件 D.既非充分也非必要条件
5.(2002河南、广西、广东7)函数f(x)=x|x+a|+b是奇函数的充要条件是( )
A.ab=0 B.a+b=0 C.a=b D.a2+b2=0
4.(2002全国文6,理5)设集合M={x|x=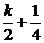 ,k∈Z},N={x|x=
,k∈Z},N={x|x=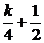 ,k∈Z},则( )
,k∈Z},则( )
A.M=N B.M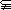 N C.M
N C.M N D.M∩N=
N D.M∩N=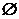
3.(2002北京,1)满足条件M∪{1}={1,2,3}的集合M的个数是( )
A.4 B.3 C.2 D.1
2.(2002京皖春,1)不等式组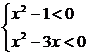 的解集是( )
的解集是( )
A.{x|-1<x<1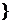 B.{x|0<x<3
B.{x|0<x<3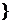
C.{x|0<x<1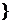 D.{x|-1<x<3}
D.{x|-1<x<3}
1.(2003京春理,11)若不等式|ax+2|<6的解集为(-1,2),则实数a等于( )
A.8 B.2 C.-4 D.-8
3、易忽视某些物质(或离子)的氧化性或还原性
例3.下列离子方程式正确的是( )。
A.标准状况下将112mL氯气通入10mL浓度为l mol/L的溴化亚铁溶液中:2Fe2++C12==2Fe3++2C1-
B.向Ca(ClO)2溶液中通入SO2 :Ca2++2ClO-+SO2+H2O==CaSO3↓+2HClO
C.在强碱溶液中,次氯酸钠与Fe(OH)3反应生成Na2FeO4:3ClO-+2Fe(OH)3=2FeO42-+3Cl-+H2O+4H+
D.Fe(OH)3溶于氢碘酸:Fe(OH)3+3H+=Fe3++3H2O-
解析:A中FeBr2电离出的Fe2+、Br-都具有较强的还原性,其中Fe2+的还原性强于Br-,故通入的C12为0.005mol时,0.0l molFeBr2中Fe2+、Br-先后依次反应。当0.0l molFe2+完全反应则需要C12为0.005mol,这样FeBr2中的Br-则没有机会再反应啦,所以反应的离子方程式应为:2Fe2++C12==2Fe3++2C1-;B中的产物CaSO3具有较强的还原性、HClO具有强的氧化性,故这两者之间还能发生氧化还原反应生成CaSO4与HCl,故错;强碱溶液中不可能生成H+,这与事实不符,所以C错误;因为Fe3+与I-之间能发生氧化还原反应生成Fe2+与I2, 故D错误
答案: A。
总之,只要抓住离子反应的实质,按照离子反应方程式的书写要求或规则去思考、去解答,一般关于离子方程式的书写与正误判断问题就不容易出现错误。
2、离子方程式正误判断技巧不明
例2.下列离子方程式正确的是( )。
A.等物质量的硫酸氢钠溶液跟氢氧化钡溶液混合:H++SO42-+Ba2++OH-==BaSO4↓+H2O
B.过氧化钠溶于水:2O22-+2H2O=4OH-+O2↑
C.向磷酸二氢钾溶液中加入过量的氢氧化钡溶液: 3Ba2++4OH-+2H2PO4-==Ba3(PO4)2↓+4H2O
D.用浓盐酸与MnO2
反应制取少量氯气:MnO2+2H++2Cl- Mn2++Cl2↑+2H2O
Mn2++Cl2↑+2H2O
解析:判断离子方程式是否正确应注意到以下几个方面:①反应物和生成物是否正确;②化学式是否拆写成离子形式正确,即只有溶于水的强电解质才能拆写成离子形式,其它均不能拆写;③是否符合题设条件的要求,如“酸碱性”“过量”或“少量”或“等量”等,对于该类问题的分析应以少量的物质完全反应、足量或过量的物质无限充足来分析;④是否遵循原子守恒、电荷守恒、电子守恒(属于氧化还原反应的离子反应),等。A中混合溶液中存在等量的Na+、H+、SO42-、Ba2+及2倍OH-,故生成BaSO4、H2O之外还有剩余的OH-、Na+,这样离子方程式应为H++SO42-+Ba2++OH-==BaSO4↓+H2O,所以A正确;B中的过氧化钠不能拆写成离子符号,故错误;C中应以磷酸二氢钾溶液完全反应考虑,故H2PO4-应全部转为PO43-,PO43-又全部生成Ba3(PO4)2沉淀,所以正确;D中的方程式中氢原子两边个数不相等或式子两边电荷不相等,故错误。
答案:A、C。
1、离子反应的实质不明
例1.已知硫酸铅难溶于水,也难溶于硝酸,但可溶于醋酸铵(NH4Ac)溶液形成无色溶液,其化学方程式为:PbSO4+2NH4Ac==Pb(Ac)2+(NH4)2SO4。当在Pb(Ac)2溶液中通入H2S时,有黑色PbS生成。表示这个反应的有关离子反应方程式是__________。
解析:离子反应的实质就使某种离子的浓度降低,可以采用生成沉淀、气体、弱电解质、配合物或发生氧化还原反应导致离子浓度减少的方法进行。Pb(Ac)2溶液中通入H2S时生成黑色沉淀只能是PbS,则化学方程式为:Pb(Ac)2+H2S=PbS↓+2HAc。其中H2S、PbS、HAc三种物质在书写离子反应方程式时均应写化学式。而Pb(Ac)2呢?由题给信息PbSO4+2NH4Ac=Pb(Ac)2+(NH4)2SO4知,此反应是复分解型的离子反应,而生成物没有沉淀、气体和水,则必有其它难电离物质,这只能是Pb(Ac)2,因此,这一反应的化学方程式就是离子反应方程式。
6、反应物的相对用量不同,离子方程式也不同。如在碳酸钠溶液中加足量盐酸时为CO32-+2H+=CO2↑+H2O,在碳酸钠溶液中加少量盐酸时为CO32-+H+=HCO3-
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com