
22. (共11分)
(1)元素符号:A H ; B C
; E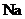 ;(每空1分)
;(每空1分)
(2)D在周期表中位置 第二周期VIA族 ;(2分)
(3)电子式为 略 ; 结构式为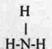 (每空2分)
(每空2分)
(4)化学方程式为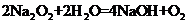 .(2分)
.(2分)
21. (10分)
(1)化学方程式: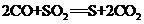 (2分)
(2分)
(2)①配平上面的氧化还原反应方程式,将系数填入方框中。
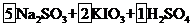 --
--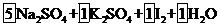 (2分)
(2分)
②氧化剂是 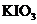 ,生成的碘是0.5mol。(每空2分)
,生成的碘是0.5mol。(每空2分)
(3)铁棒表面 无明显现象 ,则发生了钝化。(2分)
11. C 12. C 13. A 14. B 15.A 16. B 17. C 18. B 19. D 20. D
1. D 2. C 3. B 4. C 5. B 6. D 7. D 8. C 9. D 10.A
27.(12分)
现有单质铁溶于稀硝酸反应的化学方程式可表示为:
aFe+ bNO3-+cH+=dFe2++fFe3++gNO+hN2O+kH2O
试回答下列问题:
(1)下列各种情况下的数学等量关系式为:
①b,c,d,f的数学关系式为 。
②d,f,g,h的数学关系式为 。
(2)若a=16时,Fe和稀硝酸全部反应,则b的取值范同时 ,c的取值范围是 。
宁波效实中学 二00八学年 第二学期高一化学期中考试卷
26.(8分)
若原子核外电子排布的基本规律为最外层电子数不超过5个.次外层电子数不超过10个,倒数第三层电子数不超过15个,而各电子层电子的最大容量仍为2n2.则元素周期表中第三周期含有 种元素,第四周期含有 种元素,第五周期含
有 种元素.第六周期含有 种元素。
25.(8分)
现将25.6g Cu投入50mL 12mol/L的浓硝酸中,充分反应后,收集到4.48L(标准状态)NO和NO2的混合气体。 .
(1)被还原硝酸的物质的量是多少?
(2)判断25 6gCu和50mLl2mol/L的硝酸反应后何者有剩余?其物质的量是是多少?
(3)如果往反应后的体系内再加入200Ml 4mol/L的稀硫酸,是否会有气体逸出,写出
离子反应方程式,并计算气体的体积(标准状态)。
III附加题(选答题)
24.(12分)
为了在实验室利用工业原料制各少量氨气.有人设计了如下装置(图中夹持装置均已略去,其中铁触媒为反应的催化剂)。
[实验操作]
①检查实验装置的气密性后,关闭弹簧夹a、b、c、d、e。在A中先加入锌粒,向长颈漏斗注入一定量稀硫酸。打开弹簧夹c、d、e,则A中有氢气发生。在F出口处收集氧气并检验其纯度。
②关剐弹簧夹c,取下截去底部的细口瓶C,打开弹簧夹a,将氢气经导管B验纯后点燃,然后立即罩上无底细口瓶C,塞紧瓶塞,如图所示。氢气继续在瓶内燃烧,几分钟后火焰熄灭。
③用酒精灯加热反应管E.继续通氢气,待无底细口瓶C内水位下降到液面保持不变时,打开弹簧夹b,无底细口瓶C内气体经D进入反应管E,片刻后F中的溶液变红。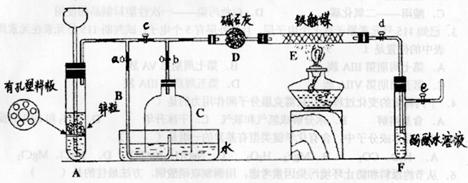
同答下列问题:
(1)检验氢气纯度的目的是 。
(2)A中有孔塑料板的作用是 ,C瓶内水位下降到液面保持不变时,A装置内
发生的现象是 ,防止了实验装置中压强过大。此时再打开弹簧夹b的原因
是 ,C瓶内气体的成份是 。
(3)反应管E中发生反应的化学方程式是 。
23.(9分)
今有一混合物的水溶液,只可能含有以下离子中的若干种:NH4+、K+、Ba2+、CO32-、SO32-、SO42-、Br-、I-,现取四份100mL溶液进行如下实验:
①第一份加盐酸后,生成无色无味气体,该气体能使饱和石灰水变浑浊;
②第二份加足量BaCl2溶液后,得干燥沉淀8.24g,经足量盐酸洗涤、干燥后,沉淀质量为2.33g;
③第三份加碱后生成气体0.04mol
④第四份加CCl4后,滴加少量氯水,振荡后,CCl4层未变色:
针对上述实验,回答下列问题
该混合液中肯定存在的离子有 .其物质的量浓度之比为 ,肯定不存在的有 ,不能确定的有 。(如果所有离子都能确定,这空填“无”)
22.(1 1分)
A、B、C、D、E五种短周期元素,它们的原子序数依次增大。B原子的最外层电子数是其次外层电子数的2倍;C的最高价氧化物对应的水化物与其氢化物反应生成一种盐X;E与A同主族:A、B、C这二种元素,每一种与D都能形成元素的原子个数比不相同的若干种化合物。
(1)写出下列元素的元素符号:A :B :E ;
(2)D在周期表中位置 ;
(3)B的最高价氧化物的电子式为 :C形成的氢化物的结构式为 。
(4)E和D形成的个数比为I:1化合物与水反应的化学方程式为 。
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com