
24.[河北正定中学2009届高三第四次月考](12分)纳米材料在绝大多数同学眼里都非常神秘。某化学学习小组决定通过查阅有关资料,自己动手实验,制备纳米铁粉。
[实验原理]
⑴用硫酸亚铁、草酸两溶液制备草酸亚铁晶体(溶解度较小)。该反应的化学方程式是 。
⑵焙烧草酸亚铁晶体:FeC2O4·2H2O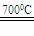 Fe+2CO2↑+2H2O↑
Fe+2CO2↑+2H2O↑
[操作步骤]
⑴草酸亚铁晶体的制备

①现有烧杯、玻璃棒、药匙、滤纸、托盘天平、FeSO4、草酸等实验用品,为配制上述两溶液,缺少的仪器有 。
②若配制的FeSO4溶液略呈黄色,可能的原因是 。
③检验草酸亚铁晶体是否洗净的方法是 。
⑵纳米铁粉的制备
 将一根长度约为12cm-14cm的玻璃管在酒精喷灯上烧制成如下图所示形状,向其中加入黄色草酸亚铁晶体。再将管口部分加热拉细,然后在酒精喷灯上均匀加热。当草酸亚铁粉末受热完全变黑,立即将管口拉细的部分放在火焰烧熔封闭,这样便得到了高纯度的纳米铁粉。
将一根长度约为12cm-14cm的玻璃管在酒精喷灯上烧制成如下图所示形状,向其中加入黄色草酸亚铁晶体。再将管口部分加热拉细,然后在酒精喷灯上均匀加热。当草酸亚铁粉末受热完全变黑,立即将管口拉细的部分放在火焰烧熔封闭,这样便得到了高纯度的纳米铁粉。
①实验中分解产生CO2所起的作用是: 。
②指导老师提醒同学们应准确把握玻璃管的烧熔封闭时间。你认为烧熔过早的后果是: ;过晚的后果是: 。
答案(1) FeSO4+H2C2O4+2H2O=FeC2O4·2H2O↓+H2SO4 (2分)
(1) ①1L容量瓶、胶头滴管 (2分,填对一个给1分,填错不扣分)
②样品中可能含有Fe3+、蒸馏水未能事先处理、溶液配制时间较长 (2分)
③取最后的洗涤液,测定洗涤液的pH,若洗涤液的pH等于7,说明已经洗涤干净 (2分)
①驱赶装置中空气,防止红热的铁被氧化 (2分)
②过早未能完全分解、过晚造成铁被氧化 (2分,其中,过早1分,过晚1分)
21..[黑龙江哈尔滨三中2008年12月高三月考考试试卷](16分)
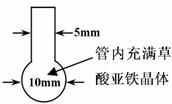
为了证明铜与稀硝酸反应产生一氧化氮,某校学生实验小组设计了一个实验,其装置如下图所示(加热装置和固定装置均已略去),B为一个用金属丝固定的干燥管,内装块状碳酸钙同体;E为一个空的蒸馏烧瓶;F是用于鼓入空气的双连打气球。
(1)实验时,先将B装置下移,使碳酸钙和稀硝酸接触产生气体,当看到 时,立刻将B装置上提,使之与稀硝酸分离。该组学生设计此操作步骤的目的为
。
(2)将A中铜丝放入稀硝酸中,给装置A微微加热,在装置A中产生无色气体,其反应的化学方程式为 ;用F向E中鼓入空气后,可观察到烧瓶E内气体变成红棕色,产生上述现象的原因是 ;
(3)红棕色气体进入C一段时间后,可观察到C中的变化是 ,该过程中发生反应的化学方程式为 。
(4)装置D的作用是 。
答案)
(1)C中石灰水变浑浊时 (2分),排出装置中的空气,防止NO被氧气氧化 (2分)
(2)3Cu+8HNO3=3Cu (NO3) 2+2NO↑+4H2O (2分),NO被氧气氧化成NO2 (2分)
(3)白色沉淀消失,或溶液变澄清(红棕色气体变为无色) (2分),
3NO2+H2O=2HNO3+NO (2分),2HNO3+CaCO3=Ca (NO3) 2+H2O (2分)
(4)吸收尾气中的NO2 (及NO、CO2)气体 (2分)
22[名校联盟 2008--2009学年高三第一学期期末考试](17分)Ⅰ.化学是一门以实验为基础的自然学科,化学实验在化学学习中具有极其重要的作用。下列关于实验的叙述正确的是 。
A.燃着的酒精灯不慎碰翻失火,应立即用湿布盖灭
B.在两支试管里分别加热NH4Cl和NH4HCO3,现象完全相同
C.在铝热反应的实验中,直接用酒精灯将铝热剂点燃
D.区别NO2气体和溴蒸气时,可将气体分别通入硝酸酸化的AgNO3溶液中
E.用滴有酚酞的水做氨的喷泉实验,只验证了氨的溶解性
Ⅱ.用中和滴定法测定烧碱的纯度,若烧碱中含有与酸不反应的杂质,试根据实验回答:
⑴将准确称取的4.3g烧碱样品配成250mL待测液,需要的主要仪器除量筒、烧杯、玻璃棒外,还必须用到的仪器有 、 。
⑵取10.00mL待测液,用 式滴定管量取。
⑶用0.2010mol·L-1标准盐酸滴定待测烧碱溶液,滴定时左手旋转酸式滴定管的玻璃活塞,右手不停地摇动锥形瓶,两眼注视 ,直到滴定到终点。
⑷根据下列数据,烧碱的纯度为 。
|
滴定次数 |
待测液体积 (mL) |
标准盐酸体积(mL) |
|
|
滴定前读数(mL) |
滴定后读数(mL) |
||
|
第一次 |
10.00 |
0.50 |
20.40 |
|
第二次 |
10.00 |
4.00 |
24.10 |
⑸以标准的盐酸溶液滴定未知的氢氧化钠溶液为例,判断下列操作引起的误差(填“偏大”、“偏小” “无影响”或“无法判断”)
①读数:滴定前平视,滴定后俯视
②未用标准液润洗滴定管
③用待测液润洗锥形瓶
④不小心将标准液滴在锥形瓶外面
⑤滴定接近终点时,用少量蒸馏水冲洗锥形瓶内壁
答案Ⅰ AD (2分,只选一个且正确给一分,有错选得0分)
Ⅱ⑴250mL容量瓶(2分,写“溶”不给分,规格不答扣一分)、胶头滴管(2分,无“胶头”扣一分)
⑵碱(2分,答“碱式”不扣分)
⑶锥形瓶中溶液颜色的变化(2分,未答“颜色”扣一分)
⑷93.5% (2分,未用百分数表示不扣分)
⑸①偏小 ②偏大 ③偏大 ④偏大 ⑤无影响 (各1分)
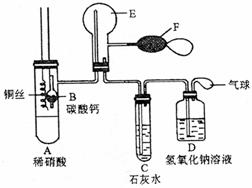
23[名校联盟 2008--2009学年高三第一学期期末考试](15分) 下图是铜与稀硝酸反应的两个实验装置图,请回答下列问题:
⑴铜与稀硝酸反应的化学方程式_______________________________________ 。
⑵I实验装置能否证明铜与稀硝酸反应生成的气体是NO __________(填“能”或“不能”),简述理由 。
⑶若用Ⅱ实验装置进行实验,以证明铜与稀硝酸反应生成的气体是NO。检查气密性的操作是 ;在烧杯中加入一定体积的稀硝酸,打开止水夹,用注射器慢慢抽取球形干燥管内的空气,稀硝酸沿着球形干燥管慢慢上升,直到充满整个球形干燥管,停止抽拉注射器,关闭止水夹,观察球形干燥管内的现象 。反应停止后,打开止水夹,用注射器抽取球形干燥管内的气体(事先已将注射器内原有的空气推出),关闭止水夹后取下注射器,并抽取一定量的空气,观察到的现象是 。
⑷上述实验完成后,将注射器内的气体通入到NaOH溶液中,其目的是 。
答案⑴3Cu+8HNO3=3Cu(NO3)2+2NO↑+4H2O(3分,未配平扣一分)
⑵不能(2分),因为圆底烧瓶中有空气(1分),空气中的氧气会与NO反应生成NO2 ,出现红棕色(1分)
⑶(其他合理答案也可给分)关闭止水夹,将干燥管放入带有水的烧杯中,若干燥管内的液面比烧杯中的液面低(1分),且过一段时间后干燥管内的液面不上升,则表明该装置的气密性良好(1分)
铜片溶解,且表面有无色气泡产生,溶液变成蓝色,液面下降(2分,能答出2个及以上现象即可给满分)
有红棕色气体产生(2分)(能说明有“红棕色”即可给满分)
⑷防止污染环境(2分)(意思相近即可给满分)
20. [2009年天津市滨海新区五所重点学校高三毕业班联考] (本题7分)轿车进入家庭,给人们带来了极大方便,但排出的尾气给环境带来了污染。现在已经研制出了汽车尾气处理装置并已投入使用,它可将汽车尾气中的有害成分转化为对环境无害的物质。某研究小组利用如下装置模拟汽车尾气的处理过程,试回答下列问题:
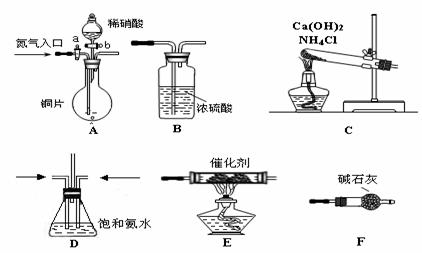
(1)仪器的连接顺序为 (填仪器代号)
(2) C中的化学反应方程式
(3)E中的化学反应方程式
(4)D装置的作用① ② 通过观察气泡数目调节气体流速
 (5)有同学认为,按上方案两种气体的体积比例不易得到很好的控制,提出改变装置连接顺序为
(5)有同学认为,按上方案两种气体的体积比例不易得到很好的控制,提出改变装置连接顺序为
但D中的液体需改成 。即便如此,该实验还存在明显缺陷,你认为它是
(6)科学研究的最终目的是应用于生产与生活实际,造福人类。你认为汽车尾气处理研究的方向是 (填代号)
A.选择适宜的氧化剂,适宜的温度,高效催化剂
B.选择适宜的还原剂,适宜的温度,高效催化剂
C.选择适宜的还原剂,高温,高效催化剂
答案、(1) F(2) 2NH4Cl+Ca(OH)2=加热= 2NH3 ↑ + CaCl2 +2H2O
(3)6NO + 4NH3 催化剂加热= 5N2 +6 H2O
(4)① 使NO与NH3 充分混合
(5)CCl4(难挥发有机溶剂) 缺少尾气处理
(6) B
19.[广西南宁武鸣高中09届高中化学2月调研试卷](20分)用如图所示装置进行实验,将液体A逐滴加入到固体B中,回答下列问题:
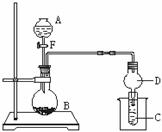 ⑴图中D装置在实验中的作用是 。
⑴图中D装置在实验中的作用是 。
⑵若 A为30%H2O2溶液,B为MnO2 ,C盛有氢硫酸(H2S)
饱和溶液,旋开E后,C中出现浅黄色浑浊的现象,写出C
中发生反应的化学方程式 。
⑶若A为浓盐酸,B为KMnO4,C中盛有KI淀粉溶液,旋
开E后,C中的现象是 ;
继续通气体于C中,足够长的时间后,发现C中溶液的颜
色消失,这是因为在溶液中I2能被Cl2氧化为HIO3,写出
该反应的离子反应方程式 。
⑷若A为浓氨水,B为生石灰,C中盛有AlCl3溶液,旋开E,足够长的时间后,C中
的现象是 ,C中发生反应的离子方程式为 。
⑸若A为浓H2SO4,B为第三周期金属元素组成的片状金属单质,它在常温下难与水反应,C为品红溶液,实验中观察到溶液红色褪去,则B为_____ _;然后向烧杯中注入沸水,又可观察到的现象是 。
⑹若B为块状大理石,C为C6H5ONa溶液,实验中观察到溶液变浑浊,则
①酸A不宜用下列的________。
A.HCl B.HNO3 C.H2SO4 D.CH3COOH
②然后向烧杯中加入沸水,可观察到的现象是 。
答案(1)防倒吸(1分) (2)2H2S + O2 == 2S ↓ + 2 H2O (3分)
(3)溶液由无色变成蓝色;(2分) I2 +5Cl2+6H2O ===12H++2IO3- + 10Cl-(3分)
(4)产生白色沉淀(2分) Al3++3NH3·H2O === Al(OH)3 ↓+ 3NH4+ (3分)
(5)Mg(1分) 溶液由无色变成红色(2分)
(6)C(1分) 溶液由浑浊变澄清(2分)
18.[2009学年丽水高中新课程水平测试高三化学试题](7分)在化学课上,围绕浓硫酸的化学性质进行了如下实验探究:将适量的蔗糖放入烧杯中,加入几滴水,搅拌均匀。然后再加入适量浓硫酸,迅速搅拌,放出大量的热,同时观察到蔗糖逐渐变黑,体积膨胀,并产生刺激性气味的气体。请回答:
(1)“加入几滴水”的作用是 。
(2)生成的黑色物质是 刺激性气味的气体主要成分是 (均填化学式)。
(3)写出产生刺激性气味气体的化学方程式: 。
(4)根据上述实验现象,表明浓硫酸具有 (填序号)。
① 酸性 ② 吸水性 ③ 脱水性 ④ 强氧化性
答案7分)(1)浓H2SO4溶于水放热,使反应发生(1分)。
 (2)C、(1分)SO2 (1分) ;
(2)C、(1分)SO2 (1分) ;
(3)C+2H2SO4 SO2+CO2+2H2O(2分)
(4)③④或②③④(2分)
17、[09海南中学高三化第四次月考.23](10分)某同学为研究盐酸与NaHCO3和Na2CO3反应的热效应,进行了下列实验(每次实验各做3次平行实验,取平均值)
|
序号 |
试剂1 |
试剂2 |
混合前的温度 |
混合后最高或最低温 度 |
序号 |
试剂1 |
试剂2 |
混合前的温度 |
混合后最高或最低温 度 |
|
Ⅰ |
50ml 水 |
2.5g NaHCO3 固体 |
200C |
18.50C |
Ⅱ |
50ml 水 |
3.2g Na2CO3 固体 |
200C |
230C |
|
Ⅲ |
35ml 稀盐 酸 |
含2.5g NaHCO3 的饱和溶液15ml |
200C |
18.80C |
Ⅳ |
35ml 稀盐 酸 |
含3.2g Na2CO3 的饱和溶液15ml |
200C |
20.60C |
|
Ⅴ |
50ml 稀盐 酸 |
2.5g NaHCO3 固体 |
200C |
17.30C |
Ⅵ |
50ml 稀盐 酸 |
3.2g Na2CO3 固体 |
200C |
|
请回答下列问题:
(1) 实验室使用的量热器一般是容积不变的装置,则用其测定的反应放出的热量 (填“是”或“不是”)该反应的焓变△H。
(2)分析表中数据可知:①NaHCO3溶于水是 热(填“吸热”或“放热”,下同)的过程,Na2CO3溶于水是 热的过程。
② 设实验Ⅰ、Ⅲ和Ⅴ的反应热分别为△H1、△H3和△H5,则三者之间的关系式为 。
③ 实验Ⅵ 中,混合后最高或最低温度接近 0C。
答案(1)不是 (2)①吸 放 ② △H5=△H1+△H3 ③ 23.6
16.[河北冀州中学08-2009学年度高 三上学期期末考试](12分)某课外小组利用H2还原黄色的WO3粉末测定W的相对原子质量,下图是测定装置的示意图,A中的试剂是盐酸。
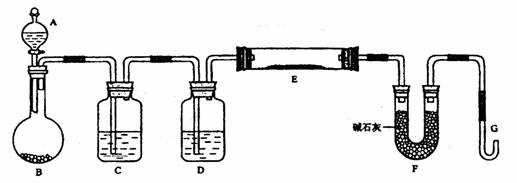
请回答下列问题:
(1)仪器中装入的试剂: D__________;
(2)连接好装置后应首先___________,
(3)操作a“加热反应管E”和操作b“从A瓶逐滴滴加液体”这两步操作应该先
进行的是_________,(填a或b)在这两步之间还应进行的操作 ____________;
(4)从实验中测得了下列数据
①空E管的质量a ②E管和WO3的总质量b
③反应后E管和W粉的总质量c (冷却到室温称量)
④反应前F管及内盛物的总质量d ⑤反应后F管及内盛物的总质量e
由以上数据可以列出计算W的相对原子质量Ar(W)的两个不同计算式(除W外,其他涉及的元素的相对原子质量均为已知):
计算式1:Ar(W)=____________:计算式2:Ar(W)=___________。
答案. (12分)(1)浓硫酸 ;(2)检查气密性 (3)操作b, 检验H2的纯度;
(4)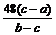 ,
, 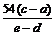 。(每空2分)
。(每空2分)
15.[徐水一中2009届高三第五次化学](共6分)某实验小组用0.50 mol/L NaOH溶液和0.50 mol/L硫酸溶液进行中和热的测定。
Ⅰ.配制0.50 mol/L NaOH溶液
(1)若实验中大约要使用245 mL NaOH溶液,至少需要称量NaOH固体 g。
(2)从图6中选择称量NaOH固体所需要的仪器是(填字母): 。
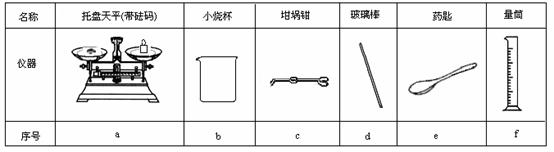
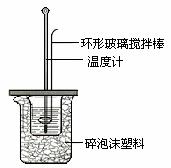 图6
图6
Ⅱ.测定稀硫酸和稀氢氧化钠中和热的实验装置如图7所示。
(1)写出该反应的热化学方程式(中和热为57.3 kJ/mol):
(2)取50 mL NaOH溶液和30 mL硫酸溶液进行实验,实验数据如下表。
①请填写下表中的空白:
|
温度 实验次数 |
起始温度t1/℃ |
终止温度 t2/℃ |
温度差平均值 (t2-t1)/℃ |
||
|
H2SO4 |
NaOH |
平均值 |
|||
|
1 |
26.2 |
26.0 |
26.1 |
30.1 |
|
|
2 |
27.0 |
27.4 |
27.2 |
33.3 |
|
|
3 |
25.9 |
25.9 |
25.9 |
29.8 |
|
|
4 |
26.4 |
26.2 |
26.3 |
30.4 |
②近似认为0.50 mol/L NaOH溶液和0.50 mol/L硫酸溶液的密度都是1 g/cm3,中和后生成溶液的比热容c=4.18 J/(g·℃)。则中和热△H= (取小数点后一位)。
③上述实验数值结果与57.3 kJ/mol有偏差,产生偏差的原因可能是(填字母) 。
a.实验装置保温、隔热效果差
b.量取NaOH溶液的体积时仰视读数
c.分多次把NaOH溶液倒入盛有硫酸的小烧杯中
d.用温度计测定NaOH溶液起始温度后直接测定H2SO4溶液的温度
答案Ⅰ、(1)5.0
(2)a b e
Ⅱ、(1)
(2)① 4.0(写“4”不给分)
② -53.5 kJ/mol (没“-”号或没单位均不给分)
③ a c d (少选、错选均不给分)
13.[豫南七校2008-2009学年度上期期末联考](8分)下图甲是课本中验证铜和浓硝酸反应的装置,乙、丙是师生对演示实验改进后的装置:
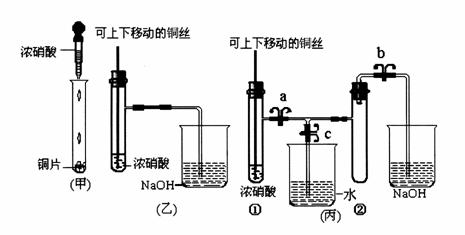
(1)甲、乙、丙三个装置中共同发生的离子反应方程式是 。
(2)和甲装置相比,乙装置的优点是① ② 。
(3)当气体充满②试管后,将铜丝提起与溶液脱离,欲使烧杯中的水进入②试管应如何操作 ______________________________________________________ 。
(4)当②试管中的NO2和水充分反应,所得溶液物质的量浓度的最大值是 。(不考虑NO2与N2O4的转化且该实验条件下气体摩尔体积设为Vm L/mol)
、答案.(共8分)
(1)Cu + 4H+ + 2NO3- = Cu2+ + 2 NO2↑+ 2H2O。 (2分)
(2)①可以控制反应。②吸收NO2气体,防止污染环境。(每空1分,共2分)
(3)先关闭b,再关闭a,然后打开c,用手捂住(热水、热毛巾、加热)②试管。(合理答案均给分)(2分)
(4)1/Vm mol·L-1 (2分)
14[西南师大附中高2009级第五次月考](14分) 无水CuSO4在强热下会发生分解反应:
CuSO4
 CuO + SO3↑
CuO + SO3↑
2SO3 2SO2↑+ O2↑
2SO2↑+ O2↑
某研究性学习小组设计了下图所示装置(夹持仪器已略去),利用D管在反应前后的质量差计算分解的无水CuSO4的质量。
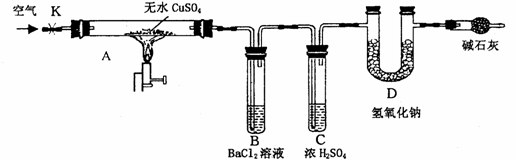
实验步骤:
①称量反应前D管的质量。
②连接好装置,关闭K,加热硬质玻璃管A一定时间后,停止加热。
③待硬质玻璃管A冷却后,打开K,通入一段时间的空气。
④再称量D管,得其反应前后的质量差为m。
(1) B管中出现的现象是_________________________________________。有关离子方程式是________________________________________________________。
(2) B管的作用是除去混合气体中的SO3,实验过程中发现B管的温度明显升高,主要原因是____________________________________________。
(3) 按上述方法实验,假设B、C、D对气体的吸收均完全,并忽略空气中CO2的影响,能否根据m计算分解的无水CuSO4的质量?___________
原因是______________________________________________________。
答案(1) 有气泡冒出,产生白色沉淀,且明显放热(2分)
SO3 + H2O + Ba2+= BaSO4↓+ 2H+
或SO3 + H2O = 2H++SO42-, SO42- + Ba2+= BaSO4↓ (4分)
(2) SO3溶于水放热(2分)
12、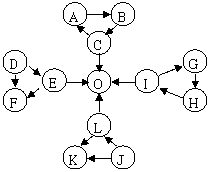 [豫南七校2008-2009学年度上期期末联考](10分)某校科研小组在探究常见物质转化时,发现部分物质可以存在如下图所示的三角关系
[豫南七校2008-2009学年度上期期末联考](10分)某校科研小组在探究常见物质转化时,发现部分物质可以存在如下图所示的三角关系
已知:
① 图中每个小三角形的三种物质中至少含有
一种相同元素。
②D、J为固体单质,O为气体单质,其余物质为常见化合物。
③A能使品红溶液褪色,也能使澄清的石灰水变浑浊;E为淡黄色化合物,与C反应生成O;与L反应也能生成O;K、L含有完全相同的元素。
④I为氧化物,电解可生成O,G和L反应生成难溶物H,H具有较强的吸附性。
(1)F的电子式为 。E物质中所含化学键类型有
(2)写出L→J的化学方程式 。
(3)常温下,测得一定浓度G溶液的pH==10,试用离子方程式表示其原因:
。
(4)写出E和C反应的离子方程式 。
答案(1)电子式略(2分) 离子键、非极性共价键(2分)
(2)CO2
+Mg 2MgO +C (2分) (3)AlO2- +2H2O==Al(OH)3+OH- (2分)
2MgO +C (2分) (3)AlO2- +2H2O==Al(OH)3+OH- (2分)
(4)2Na2O2+4H+==4Na+ +O2 +2H2O (2分)
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com