
3.[双流县2009届高中毕业班理科综合能力测试](15分)U、W、X、Y、Z都是短周期元素,已知W、X、Y、Z原子序数依次增大,且W、Z同主族,X原子的最外层比次外层多3个电子,W与X、Y可分别形成电子总数相等的分子,且W与Y形成的化合物常温下为液态,W、U的最外层电子数之和与X的最外层电子数相等。请回答下列问题:
(1)Z元素在周期表中的位置 。
(2)W与Y形成的化合物的电子式 。
(3)W、X、Y可组成原子个数比为4:2:3的化合物,该化合物的水溶液的pH 7(填“>”、“<”或“=”),其原因是 (用离子方程式表示)。
(4)U元素最高价氧化物晶体的硬度 (填“大”或“小”),其理由是
。
(5)你认为W、X、Y元素形成的化合物之间能否
(填“能”或“不能”)发生反应:XY+XW3 WXY2+W2Y, 得出上面结论的理由是:
WXY2+W2Y, 得出上面结论的理由是:
。
(6)若U、Y两元素形成的化合物与XY2在一定条件下反应生成两种可参与大气循环的气体,则U元素的符号是 。
 答案..(15分)(1)三周期ⅠA族 (2分)
答案..(15分)(1)三周期ⅠA族 (2分)
(2) (2分)
(3)< (2分) NH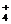 + H2O
+ H2O NH3·H2O+H
NH3·H2O+H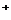 (2分)
(2分)
(4)大 (1分)SiO2是原子晶体(2分)或 小 CO2是分子晶体
(5)不能(1分) 在此反应关系中,只有失电子的物质,没有得电子的物质 (2分)
(6)C (2分)
2. [四川省乐山市2009届高三上学期第一次调研考试]
|
|
元素代号 |
U |
V |
W |
X |
Y |
Z |
.M |
|
原子半径/nm |
0.037 |
0.157 |
0.074 |
0.075 |
0.077 |
0.143 |
0.102 |
|
主要化合价 |
+1 |
+1 |
-2 |
-3,+5 |
+2,+4 |
+3 |
-2,+6 |
请回答:
(1)X在元素周期表中的位置是 ;
(2)V、W、Z三种元素的离子具有相同的电子层结构,三者的离子半径由大到小顺是
(用元素符号表示);并用离子方程式表示出Z离子可作净水剂的
原因 。
(3)M的单质能跟V的最高价氧化物水化物的热浓溶液发生氧化还原反应,生成的两种正盐的水溶液均呈碱性,写出该氧化还原反应的离子方程式____________ _____ _。
(4)W、X、Y分别与U均可形成10电子共价化合物,晶体类型均为 ,其中,属于非极性分子的是(写化学式)__ ,若将其作为燃料,以熔融的K2CO3为电解质,空气作为氧化剂,并选择适当的隋性电极,组成原电池。写出该电池工作时的负极反应式 。
答案.(1)第二周期VA族(2分);
(2)O2-> Na+ > Al3+ (2分), Al
3++3H2O 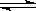 Al(OH)3(胶体)+3H+(2分);
Al(OH)3(胶体)+3H+(2分);
(3)3S+6OH-=2S2-+SO32-+3H2O(3分);
(4)分子晶体(2分)、CH4(2分)、CH4+4CO32--8e-=5CO2+2H2O (3分)。
1.[四川梓潼一中高2009级高考模拟理科综合考试(A-1)](15分)有X、Y、Z、W四种短周期元素,原子序数依次增大。X的阳离子就是一个质子。Z、W在周期表中处于相邻位置,它们的单质在通常状况下均为无色气体。Y原子的最外层电子数是次外层电子数的2倍。请回答:
 (1)Z2的电子式为
,Y的原子结构示意图为
,YW2的结构式为
。
(1)Z2的电子式为
,Y的原子结构示意图为
,YW2的结构式为
。
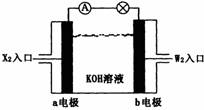
(2)将X2、W2按右图所示通入某燃料电池中,其中,
b电极的电极反应式为 。
若有16gW2参加反应,转移的电子数是 mol。
(3)由X、Y、Z、W四种元素组成的无机酸酸式盐,
与足量的NaOH溶液在加热条件下反应的离子方程式为
。
答案.(1)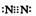
 O=C=O
(各2分)
O=C=O
(各2分)
(2)O2+2H2O+4e-=4OH- (3分)
2 (3分)
(3)NH4++HCO3-+2OH- NH3↑+2H2O+ CO32-
(3分)
NH3↑+2H2O+ CO32-
(3分)
28. (鞍山市13中学2009届高三第三次模拟考试)
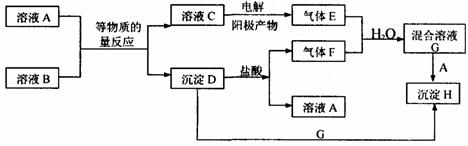
(10分)A、B均为无色盐溶液,B的焰色反应呈黄色,一定条件下A、B可以发生图所示的物质之间的一系列变化:
(鞍山市13中学2009届高三第三次模拟考试)
(10分)A、B均为无色盐溶液,B的焰色反应呈黄色,一定条件下A、B可以发生图所示的物质之间的一系列变化:
若E和F均为有刺激性气味的气体,H不溶于酸、不溶于水,请填写下列空白。
(1)气体E的化学式为 ,气体F的化学式为 ,C中溶质的化学式为 。
(2)写出下列反应的离子方程式:
C→E ;
D+G→H ;
(3)在混合溶液G中滴人几滴石蕊溶液,可见现象为 ,
原因是 。
答案)
(1) Cl2, SO2, NaCl (各1分)
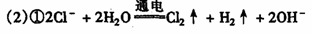 (2分)
(2分)
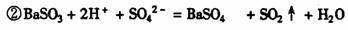 (2分)
(2分)
(3) 变红色(1分).
A为BaCl2,B为Na2SO3,因A与B是等物质的量混合(Na2SO3+BaCl2=2NaCl+BaSO3↓)所以电解NaCl饱和溶液得到的Cl2和BaSO3与H2SO4反应生成的SO2亦为等物质的量,即Cl2与SO2恰好完全反应:SO2+Cl2+2H2O=2HCl+H2SO4,最终得到C溶液只有酸性而无漂白性。(2分)
27.(鞍山市13中学2009届高三第三次模拟考试)已知两瓶气体分别是HCl 和Cl2 ,可以区别它们的方法或试剂是( C )
①观察颜色 ②打开瓶盖看有无白雾 ③湿润的淀粉试纸 ④湿润的红色石蕊试纸
⑤湿润的蓝色石蕊试纸 ⑥AgNO3 溶液
A. ①②③④ B. ①②⑤⑥ C. ①②④⑤ D. ①②③⑥
26、(四川省绵阳中学2009届高三二诊模拟试题 学)氟气是氧化性最强的非金属单质。等物质的量的F2与NaOH在稀溶液中反应生成NaF、H2O和一种气体,该气体是( B )
学)氟气是氧化性最强的非金属单质。等物质的量的F2与NaOH在稀溶液中反应生成NaF、H2O和一种气体,该气体是( B )
A.HF
B.OF2
C.H2 D.O2
25、(9分)向含a mol FeI2和b mol FeBr2的混合液中逐渐通入c mol Cl2,试分别填写不同c值范围内被氧化的离子及其物质的量。
|
c值范围 |
被氧化的离子符号 |
被氧化离子的物质的量/mol |
|
0<c≤a |
① |
② |
|
a<c≤(3a+b)/2 |
③ |
④ |
|
(3a+b)/2<c≤3(a+b)/2 |
⑤ |
⑥ |
答案.①I- ②2c ③Fe2+ ④2c-2a ⑤Br- ⑥2c-3a-b
24、[四川省绵阳中学2009届高三二诊模拟试题]氟气是氧化性最强的非金属单质。等物质的量的F2与NaOH在稀溶液中反应生成NaF、H2O和一种气体,该气体是(B )
A.HF B.OF2 C.H2 D.O2
23.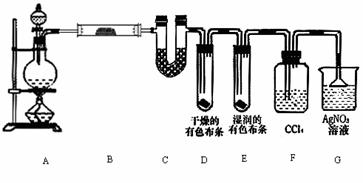 (16分)某校化学实验兴趣小组为了探究在实验室制备Cl2的过程中有水蒸气和HCl挥发出来,同时证明氯气的某些性质,甲同学设计了如右图所示的实验装置(支撑用的铁架台省略),按要求回答问题:
(16分)某校化学实验兴趣小组为了探究在实验室制备Cl2的过程中有水蒸气和HCl挥发出来,同时证明氯气的某些性质,甲同学设计了如右图所示的实验装置(支撑用的铁架台省略),按要求回答问题:
(1)写出A中发生反应的化学方程式 。
(2)① 装置B中盛放的试剂为 ,作用是 。
②装置D和E中出现的不同现象说明的问题是 。
③装置F的作用是 。
④写出装置G中发生反应的离子方程式 。
(3)乙同学认为甲同学的实验有缺陷,不能确保最终通入AgNO3溶液中的气体只有一种。为了确保实验结论的可靠性,证明最终通入AgNO3溶液的气体只有一种,乙同学提出在某两个装置之间再加一个装置。你认为该装置应加在 之间(填装置字母序号),装置中应放入 (填写试剂或用品名称)。
答案.(每空2分,共16分)(1)4HCl(浓)十Mn02  MnCl2+C12↑+2H2O;
MnCl2+C12↑+2H2O;
(2)① 无水硫酸铜;证明有水蒸气产生(其它合理答案也给分); ②氯气无漂白性,次氯酸有漂白性;③吸收氯气; ④Ag++Cl-=AgCl↓;
(3)F G; 湿润的淀粉KI试纸(或湿润的有色布条)。
22、[南昌市高三化学综合能力检测题09.2](共8分)在上个世纪,人们很早就得到高氯酸和高碘酸及其盐,但无论用什么方法都得不到+7价溴的化合物。直到1968年,有个名叫Appelman的化学家用发现不久的XeF2和HBrO3反应,首次检测出BrO4-。随后在1971年用XeF2和含KOH、KBrO3的水溶液反应,得到了很纯的KBrO4晶体。
(1)已知XeF2和水反应放出氧气和氙气,氟则以化合态留在水溶液中。其化学方程式为:_____________________。该反应中的氧化剂是_______________,被氧化的元素是_______________。
(2)写出XeF2和含KOH、KBrO3的水溶液反应的化学方程式,标明电子转移方向和数目:
___________________________________________________
答案(1)2XeF2+2H2O → O2↑+2Xe↑+4HF (2分,产物不正确不给分,未配平扣1分) ,
XeF2 (1分),负二价的氧元素(1分)
(2)XeF2+2KOH+KBrO3 → KBrO4+Xe↑+2KF+H2O
(反应物、产物都正确1分,配平1分,电子转移方向1分,电子转移数目1分。)
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com