
6.[广东梅州五华县横陂中学2009届高考模拟测试.2月]下图是分离乙酸乙酯、乙酸和乙醇混合物的实验操作流程图
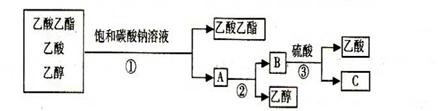
上述试验过程中,所涉及的三次分离操作分别是 ( B )
A.①蒸馏②过滤③分液 B.①分液②蒸馏③蒸馏
C.①蒸馏②分液③分液 D.①分液②蒸馏③结晶、过滤
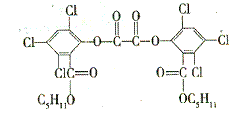 7.[广东梅州五华县横陂中学2009届高考模拟测试.2月]“魔棒”常被用于晚会现场气氛的渲染。
7.[广东梅州五华县横陂中学2009届高考模拟测试.2月]“魔棒”常被用于晚会现场气氛的渲染。
其发光原理是利用H2O2氧化草酸二酯产生
能量,该能量被传递给荧光物质后发出荧光,
草酸二酯(CPPO)结构简式如右图所示:
下列有关说法不正确的是: ( BD )
A.草酸二酯属于芳香族化合物
B.草酸二酯的分子式为C26H23O8Cl6
C.草酸二酯难溶于水
D.1mol草酸二酯最多可与4molNaOH反应
5、(四川省绵阳中学2009届高三二诊模拟试题 学)PMMA常被用作光盘的支持基片,PMMA的单体A(C5H8O2)不溶于水,可以发生以下变化:
学)PMMA常被用作光盘的支持基片,PMMA的单体A(C5H8O2)不溶于水,可以发生以下变化:
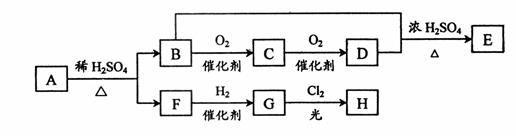
已知:E能发生银镜反应,F与NaHCO3溶液反应能产生气体,G的一氯取代产物H有两种不同的结构。请回答:
(1)F分子中含有的官能团的名称是:_____________________________。
(2)由F转化成G的反应类型属于(选填序号)____________________。
①氧化反应 ②还原反应 ③加成反应 ④取代反应
 (3)由B与D反应生成E的化学方程式为__________________________。
(3)由B与D反应生成E的化学方程式为__________________________。
(4)B是一种新型汽车燃料。已知在通常情况下,1gB完全燃烧生成CO2和液态水时放热22.7kJ。则B的燃烧热为____________________。
(5)由A发生加聚反应可得PMMA,该反应的化学方程式是________________。
PMMA为_______________型结构,具有____________________性。
答案:(1)碳碳双键,羧基(2)①③ (3)CH3OH+HCOOH==HCOOCH3+H2O ‘
(4)726.4KJ/mol (5)略
4、(四川省绵阳中学2009届高三二诊模拟试题 学)八角茴香含有一种抗禽流感病毒的重要成分--莽草酸,其结构简式为:
学)八角茴香含有一种抗禽流感病毒的重要成分--莽草酸,其结构简式为:
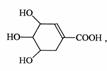

则莽草酸不具有的性质是( A )


A.遇FeCl3溶液呈紫色 B.能发生消去反应
C.能与H2发生加成反应 D.1mol莽草酸只能与1molNaOH反应
3、(四川省绵阳中学2009届高三二诊模拟试题 学)下列实验方案合理的是( D )
学)下列实验方案合理的是( D )
A.蔗糖水解(H2SO4作催化剂)后,在水解液中加新制的Cu(OH)2悬浊液加热煮沸检验水解产物
B.用氨水清洗做过银镜反应的试管
C.除去苯中的苯酚,加饱和NaHCO3溶液再分液
D.用新制的生石灰,通过加热蒸馏,以除去乙醇中的少量水
2、(四川省绵阳中学2009届高三二诊模拟试题 学)食品保鲜膜按材质分为聚乙烯(PE);聚氯乙烯(PVC)等种类。PE保鲜膜可直接接触食品,PVC保鲜膜则不能直接接触食品,它对人体有潜在危害。下列有关叙述不正确的是( B )
学)食品保鲜膜按材质分为聚乙烯(PE);聚氯乙烯(PVC)等种类。PE保鲜膜可直接接触食品,PVC保鲜膜则不能直接接触食品,它对人体有潜在危害。下列有关叙述不正确的是( B )
A.PE、PVC都属于链状高分子化合物,受热易熔化
B.PE、PVC的单体都是不饱和烃,能使溴水褪色
C.焚烧PVC保鲜膜会放出有毒气体HCl
D.废弃的PE和PVC均可回收利用以减少白色污染
1.([双流县2009届高中毕业班理科综合能力测试]16分)某兴趣小组同学进行乙醛的银镜反应实验的操作步骤如下:
A.在试管里先注入少量NaOH溶液,振荡,然后加热煮沸。把NaOH溶液倒去后,再用蒸馏水洗净试管备用。
B.在洗净的试管里配置银氨溶液。
C.沿试管壁加入乙醛稀溶液。
D.加热。
请回答下列问题:
(1)步骤A中加NaOH溶液振荡,加热煮沸的目的是 。
(2)简述银氨溶液的配置过程:
。
(3)步骤D应选择的加热方法是 (填下列装置编号),理由是
。

(4)乙醛发生银镜反应的化学方程式 。
(5)该兴趣小组的同学还对乙醛进行银镜反应的最佳实验条件进行了探究(部分实验数据如下表):
|
实验变量 实验序号 |
银氨溶液的量/mL |
乙醛的量/滴 |
温度/℃ |
反应混合液的pH |
出现银镜的时间/min |
|
1 |
1 |
3 |
65 |
11 |
5 |
|
2 |
1 |
3 |
45 |
11 |
6.5 |
|
3 |
1 |
5 |
65 |
11 |
4 |
①实验1和实验2,探究的是 。
②当银氨溶液的量为1 mL,乙醛的量为3滴,温度为50℃,反应混合液pH为11时,出现银镜的时间 。
③你认为探究乙醛进行银镜反应的最佳条件,除了测量银镜出现的时间外,还需要比较不同条件下形成银镜的 。
(6)银氨溶液放久后会产生氮化银而引起爆炸,直接排放会污染环境,且造成银资源的浪费。实验室从反应后的废液中回收银的实验流程如下:

已知:[Ag(NH3)2]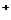 在溶液中存在平衡:[Ag(NH3)2]
在溶液中存在平衡:[Ag(NH3)2]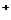
 Ag
Ag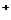 +2NH3。
+2NH3。
①写出废液与稀HNO3反应的离子方程式 。
②加入的铁粉要过量的目的是 。
③该实验过程中可能产生的大气污染物是 。
答案(1)去除试管内壁的油污,保证试管洁净 (1分) (2)在洁净的试管里加入1 mL 2%的AgNO3溶液,然后一边摇动试管,一边逐滴滴入2%的稀氨水,至最初产生的沉淀恰好溶解为止 (3分)
(3)乙 (1分)加热时试管抖动或试管中液体沸腾都将影响银镜产生的效果(2分)
(4)CH3CHO + 2Ag(NH3)2OH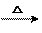 CH3COONH4
+ 2Ag↓+ 3NH3 + H2O(2分)
CH3COONH4
+ 2Ag↓+ 3NH3 + H2O(2分)
(5)①温度对反应速率的影响(1分) ② 5-6.5 min (1分) ③光亮程度(1分)
(6)①[Ag(NH3)2]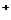 +OH
+OH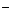 +3H
+3H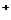 ===Ag
===Ag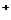 +2NH
+2NH + H2O (2分)
+ H2O (2分)
②使溶液中的Ag 全部还原 (1分) ③ NO (1分)
全部还原 (1分) ③ NO (1分)
1.[四川省乐山市2009届高三上学期第一次调研考试](16分)有一瓶澄清溶液,可能含有K+、Mg2+、Ba2+、Al3+、Fe3+、SO42-、CO32-、NO3-、Cl-、I-。根据如下各步实验,完成相应填空。
(1)用pH试纸检验,溶液呈强酸性,说明一定不存在的是(填离子符号,下同) ;
 (2)取部分溶液,加入少量CCl4及数滴新制的氯水,经振荡、静置后,CCl4层呈紫红色,反应的离子方程式为
,该实验说明原溶液一定存在的离子是
,一定不存在的离子是
;
(2)取部分溶液,加入少量CCl4及数滴新制的氯水,经振荡、静置后,CCl4层呈紫红色,反应的离子方程式为
,该实验说明原溶液一定存在的离子是
,一定不存在的离子是
;
(3)另取部分溶液,逐滴加入稀NaOH溶液,使溶液从酸性逐渐转变为碱性,在滴加过程中及滴加完毕后,溶液中均无沉淀产生,说明原溶液中一定不存在的离子是 ;
(4)取(3)所得溶液加热,加入Na2CO3溶液,有白色沉淀产生,说明原溶液中一定还存在的离子是 ,一定不存在的离子是 。
通过上述实验,还不能确定是否存在的是 。
27、[湖北省部分重点中学2009届高三第二次联考理综](17分)
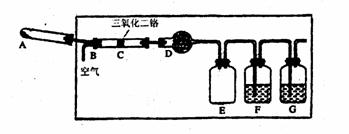 硝酸是一种重要的化工原料,工业上通常采用氨氧化法制取。某校化学兴趣小组的同学在实验室设计了如下所示的装置来模拟工业制硝酸(二氧化二铬为催化剂,加热及夹持装置末画出):
硝酸是一种重要的化工原料,工业上通常采用氨氧化法制取。某校化学兴趣小组的同学在实验室设计了如下所示的装置来模拟工业制硝酸(二氧化二铬为催化剂,加热及夹持装置末画出):
(1) 下列仪器中所装试剂:A:_______,D __________,F___________。
(2) C中发生反应的化学方程式是_________________。
(3) 实验时,A、C两装置均需加热,应先加热__________装置。原因是____________。
(4) 如果空气过量,则G中可能发生的反应总的离子方程式是______________________
(仅写一个)。 .
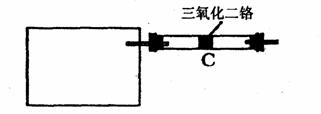 (5) 若保留上图中黑色粗线框内的装置但去掉通空气的导管B,将C装置中的双孔橡皮 塞换成单孔橡皮塞,请你用图示的方法设计一个简单的实验方案同样完成硝酸的制取(在下图方框中画出装置图,并注明所用的试剂)。
(5) 若保留上图中黑色粗线框内的装置但去掉通空气的导管B,将C装置中的双孔橡皮 塞换成单孔橡皮塞,请你用图示的方法设计一个简单的实验方案同样完成硝酸的制取(在下图方框中画出装置图,并注明所用的试剂)。
答案
|
(2)4NH3+5O2======4NO+6H2O(3分)
(3)C(2分),加热C使之达到催化剂的活性温度,加快反应速率(1分),提高NH3的利用率(1分)(共4分)
(4)4NO2+O2+40H-=4NO3-+2H2O(或4NO+3O2+4OH-=4NO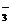 +2H2O)(3分)
+2H2O)(3分)
 (5)
(5)
(试剂2分,画图(装置)2分,共4分)
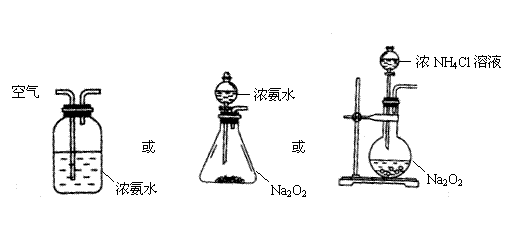
26. (15分)长期存放的亚硫酸钠可能会被空气中的氧气氧化。某化学兴趣小组通过实验来测定亚硫酸钠试剂的被氧化的程度,设计了右图实验:请回答下面的问题:
(15分)长期存放的亚硫酸钠可能会被空气中的氧气氧化。某化学兴趣小组通过实验来测定亚硫酸钠试剂的被氧化的程度,设计了右图实验:请回答下面的问题:
(1)若将虚线框内的分液漏斗换成长颈漏斗,
则应该怎样检查虚线框内装置的气密性? 。
(2)D装置中反应的化学方程式为
。B装置中反应的离子方程为 。
(3)称量ag Na2SO3样品放入锥形瓶中,向B装置反应后的溶液中加入足量的BaCl2溶液充分反应,过滤、洗涤、干燥,得白色沉淀bg,原样品中Na2SO3的质量分为数为 。
(4)为保证实验测定的准确性,则C装置中反应的离子方程式为 。
(5)现有以下试剂:①蒸馏水、②稀盐酸、③稀硝酸、④BaCl2溶液、⑤Ba(NO3)2溶液,请从中选择合适试剂,设计一种不同的实验方法测定试样中无水亚硫酸钠被氧化的程度
。
答案(1)关闭弹簧夹(或止水夹) ,由长颈漏斗向锥形瓶中加水至漏斗内液面高于锥形瓶内液面,过一段时间观察液面是否变化,若不变,说明气密性好,否则说明装置漏气(其它答案合理也给分)(共3分)
,由长颈漏斗向锥形瓶中加水至漏斗内液面高于锥形瓶内液面,过一段时间观察液面是否变化,若不变,说明气密性好,否则说明装置漏气(其它答案合理也给分)(共3分)
△
(2)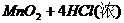 ====
====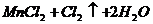 (2分)
(2分)
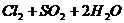 ====
====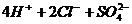 (2分)
(2分)
(3)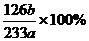 (3分)
(3分)
(4)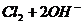 ====
====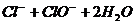 (2分)
(2分)
(5)①②④ (3分)
25.[2009年甘肃省河西五市二十校高三第一次联考](10分)某化学实验小组同学为了证明和比较SO2和氯水的漂白性,设计了如图所示的实验装置。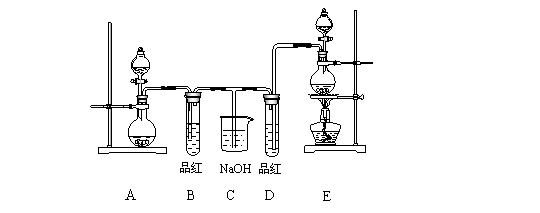

(1)实验室常用装置E制备Cl2,指出该反应中浓盐酸所表现出的性质: 。
(2)反应开始后,发现B、D两个试管中的品红溶液都褪去,停止通气后,给两个试管加热,两个试管中的现象分别为B: ,D: 。
(3)装置中C的作用是 。
(4)该实验小组的同学将SO2 和Cl2先混合后通入品红溶液,通气一段时间后,品红溶液几乎不褪色,经测定品红溶液显强酸性。品红不褪色的原因: (用化学方程式表示)。
答案(1)酸性、还原性(写出一种得1分)
(2)出现红色 溶液无色
(3)吸收尾气以防污染环境
(4)Cl2+SO2+ 2H2O=2HCl+H2SO4
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com