
7、函数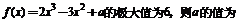
A、0 B、1 C、5 D、6
6、若函数

5、方程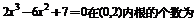
A、0 B、1 C、2 D、3
4、若函数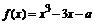
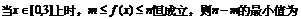
A、2 B、4 C、18 D、20
3、已知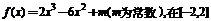 上有最大值为3,那么此函数在
上有最大值为3,那么此函数在
[-2,2]上的最小值为
A、-37 B、-29 C、-5 D、-11
2、函数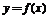 是定义在R上的可导函数,则
是定义在R上的可导函数,则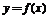 为R上的单调增函数是
为R上的单调增函数是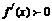 的________条件
的________条件
A、充分不必要 B、必要不充分 C、充要 D、既不充分也不必要
1、函数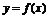 是定义在R上的可导函数,则
是定义在R上的可导函数,则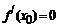 是函数在
是函数在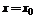 时取得极
时取得极
值的________条件
A、充分不必要 B、必要不充分 C、充要 D、既不充分也不必要
17.(8分)已知A、B、C、D是中学化学中常见的四种不同多核粒子,它们之间存在如下关系:
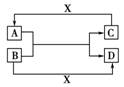
(1)如果A、B、C、D均是10电子的粒子,且X为OH-,请写出:A的结构式________,D的电子式________。
(2)如果A和C是18电子的粒子,B和D是10电子的粒子,且X为H+,请写出:
①A与B在溶液中反应的离子方程式________________________________________________________________________
________________________________________________________________________。
②根据上述离子方程式,可以判断C与B结合质子的能力大小是(用化学式或离子符号表示):________>________。
(3)已知肼(H2N-NH2)和甲胺(H3C-NH2)都是含18个电子的分子,分析肼和甲胺的结构特点并从中受到启发,写出与其具有相同电子数的有机化合物的结构简式:________________________________________________________________________。
[解析] (1)能与OH-反应的多核10电子微粒主要有NH4+、H3O+、HF等,而HF一旦与OH-反应后生成的F-就是单核微粒了,结合A、B、C、D之间的反应关系可知:A为NH3,B为H3O+,C为NH4+,D为H2O。
(2)18电子多核微粒在酸性条件下转化的有:H2S和HS-,故A为H2S,C为HS-,B为OH-,D为H2O。OH-可夺取H2S中的H+,可见吸H+能力:OH->HS-。
(3)9电子自由基有:-F、-OH、-CH3、-NH2等,两两组合形成的分子均含18个电子。
[答案]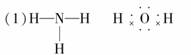
(2)①H2S+OH-===HS-+H2O
②OH- HS-
(3)CH3-CH3(或CH3-OH)
16.(10分)A、B、X、Y和Z是原子序数依次递增的短周期元素,其中A与Y同主族,X与Z同主族,A与B和X均可形成10个电子的化合物;B与Z的最外层电子数比为2∶3,常见化合物Y2X2与水反应生成X的单质,其溶液可使酚酞试液变红。请回答下列问题:
(1)Z的原子结构示意图为________;化合物BA4的电子式为______________。
(2)化合物Y2X2中含有的化学键类型有________(填序号)。
A.离子键 B.极性共价键
C.非极性共价键 D.氢键
(3)化合物A2X和A2Z中,沸点较高的是____________(填化学式),其主要原因是________________________________________________________________________
________________________________________________________________________。
(4)A与X和A与Z均能形成18个电子的化合物,此两种化合物发生反应的化学方程式为________________________________________________________________________。
[解析] Y2X2与水反应生成X单质,其溶液可使酚酞试液变红,则Y为Na,X为O,又X与Z同主族,则Z为S,A、B、X、Y、Z原子序数递增,B与Z最外层电子数之比为2∶3,则B为C,又A与B和X均可形成10电子化合物,则A为H。
(1)化合物BA4为CH4。
(2)Y2X2为Na2O2,既含有离子键又含有非极性共价键。
(3)H2S和H2O相比,H2O沸点高,因为水分子间存在氢键作用。
(4)H2O2具有氧化性,H2S具有强还原性,H2O2与H2S反应生成H2O和S。
[答案]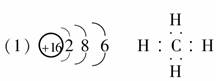
(2)AC (3)H2O 水分子间存在氢键
(4)H2O2+H2S===2H2O+S↓
15.(13分)A、B、C、D、E、F是原子序数依次增大的六种常见元素,其性质如下:
|
元素 |
性质 |
|
A |
单质在C2中燃烧可生成AC和AC2两种气体 |
|
D |
原子的最外层电子与其最内层电子数相同 |
|
E |
单质在C2中燃烧的产物可使品红溶液褪色 |
|
F |
与C元素形成的化合物F3C4具有磁性 |
请回答下列问题:
(1)F元素在周期表中的位置是____________;AC2的电子式为__________。
(2)D单质在空气中燃烧的化学方程式为________________________________________________________________________
________________________________________________________________________。
(3)元素C与元素E相比,非金属性较强的是________(用元素符号表示),能证明这一结论的事实是________________________。
(4)A、B、C形成的10电子氢化物中,热稳定性最好的是________(写化学式);B、C的氢化物分子结合H+能力较强的是________(写化学式),用离子方程式加以说明______________________________。
[答案] (1)第4周期Ⅷ族 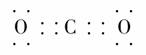 (2)2Mg+O22MgO,3Mg+N2Mg3N2,2Mg+CO22MgO+C
(2)2Mg+O22MgO,3Mg+N2Mg3N2,2Mg+CO22MgO+C
(3)O 氧的氢化物比硫的氢化物稳定(或S+O2SO2)
(4)H2O NH3 NH3+H3O+===NH4++H2O
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com