
题目列表(包括答案和解析)
1、2008年北京奥运会“祥云”火炬用的是环保型燃料--丙烷。已知丙烷的燃烧热为2221.5 KJ/mol,下列有关说法不正确的是( )
A、丙烷的沸点比正丁烷低
B、奥运火炬燃烧主要是将化学能转变为热能和光能
C、丙烷、空气及铂片可组成燃料电池,在丙烷附近的铂极为电池的正极
D、丙烷燃烧的热化学方程式为C3H8(g)+5O2(g)=3CO2(g)+4H2O(1);
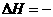 2 221.5 kJ/mol
2 221.5 kJ/mol
20.用50mL0.50mol/L盐酸与50mL0.55mol/LNaOH溶液在如图所示的装置中进行 中和反应。通过测定反应过程中所放出的热量可计算中和热。回答下列问题:
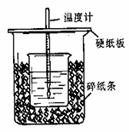 (1)从实验装置上看,图中尚缺少的一种玻璃用品是
。
(1)从实验装置上看,图中尚缺少的一种玻璃用品是
。
(2)烧杯间填满碎纸条的作用是 。
(3)大烧杯上如不盖硬纸板,求得的中和热数值 。
(填“偏大、偏小、无影响”)
(4)如果用60mL0.50mol/L盐酸与50mL0.55mol/LNaOH溶液进行反应,与上述实验相比,所放出的热量 (填“相等、不相等”),所求中和热 (填“相等、不相等”)。
简述理由 。
选 做 题
19.火箭推进器中盛有强还原剂液态肼(N2H4)和强氧化剂液态双氧水。当它们混合反应时,即产生大量氮气和水蒸气,并放出大量的热。已知0.4mol液态肼与足量的液态双氧水反应,生成氮气和水蒸气,放出256.652KJ的热量。
(1)反应的热化学方程式为 。
(2)又已知H2O(l)=H2O(g);ΔH=+44kJ/mol。则16g液态肼与液态双氧水反应生成液态水时放出热量是 KJ。
(3)此反应用于火箭推进,除释放大量热和快速产生大量气体外,还有一个很大的优点是
18.(1)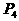 (s,白磷)+
(s,白磷)+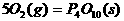
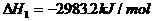
(2)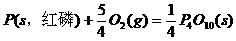
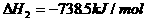
则白磷转化为红磷的热化学方程式______ ___ 。
相同的状况下,能量较低的是_________;白磷的稳定性比红磷___________(填“高”或“低”)。
17.(4分)由金红石(TiO2)制取单质Ti,涉及到的步骤为:TiO2 TiCl4
TiCl4 Ti
Ti
已知:① C(s)+O2(g)=CO2(g); DH=-393.5 kJ·mol-1
② 2CO(g)+O2(g)=2CO2(g); DH=-566 kJ·mol-1
③ TiO2(s)+2Cl2(g)=TiCl4(s)+O2(g); DH=+141 kJ·mol-1
则TiO2(s)+2Cl2(g)+2C(s)=TiCl4(s)+2CO(g)的 DH=
16.甲醇质子交换膜燃料电池中将甲醇蒸气转化为氢气的两种反应原理是:
①CH3OH(g)+H2O(g)=CO2(g)+3H2(g) △H= + 49.0 kJ·mol-1
②CH3OH(g)+1/2O2(g)=CO2(g)+2H2(g) △H= -192.9 kJ·mol-1
下列说法正确的是 ( )
A.CH3OH的燃烧热为192.9 kJ·mol-1
B.CH3OH的燃烧热为676.7 kJ·mol-1
C.CH3OH转变成H2的过程一定要吸收能量
D.根据②推知反应: CH3OH(l)+1/2O2(g)=CO2(g)+2H2(g)的△H>-192.9kJ·mol-1
15.已知25℃、101kPa条件下:4Al (s) + 3O2 (g) = 2Al2O3 (s) △H = -2834.9 kJ/mol
4Al (s) + 3O3 (g) = 2Al2O3 (s) △H = -3119.91kJ/mol
由此得出的结论正确的是( )
A.等质量的O2比O3能量低,由O2变O3 为吸热反应
B.等质量的O2比O3能量低,由O2变O3 为放热反应
C.O3比O2稳定,由O2变O3 为吸热反应
D.O2比O3稳定,由O2变O3 为放热反应
14.已知下列两个热化学方程式2H2(g)+O2(g)=2H2O(1) △H= -571.6 kJ/mol
C3H8(g)+5O2(g)=3CO2(g)+4H2O(1) △H=-2220.0 kJ/mol
实验测得,5mol氢气和丙烷的混合气体完全燃烧时放热3847kJ,则混合气体中氢气与丙
烷的体积比是( )
A.1:3 B.3:1 C.1:4 D.1:1
13.1g氢气完全燃烧生成液态水放出142.9kJ的热量, 表示该反应的热化学方程式中, 正确的是( )
A.2 H2(g) + O2(g) = 2 H2O(l);△H =-142.9kJ/mol
B.2 H2(g) + O2(g) = 2 H2O(l);△H =-571.6kJ/mol
C.2 H2 + O2 = 2 H2O;△H =-571.6kJ/mol
D.H2(g) +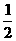 O2(g) = H2O(l);△H =-285.8kJ/mol
O2(g) = H2O(l);△H =-285.8kJ/mol
12.已知H-H键能为436 KJ/mol,H-N键能为391KJ/mol,根据化学方程式:
N2 + 3H2 = 2NH3 ΔH=-92.4 KJ/mol,则N≡N键的键能是( )
A.431 KJ/mol B.946 KJ/mol C.649 KJ/mol D.869 KJ/mol
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com