
题目列表(包括答案和解析)
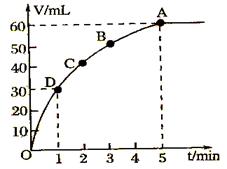
21、l mol MnO2粉末加入50mL过氧化氢的溶液里(ρ=1.1g•L-1),在标准状况下,放出气体的体积y和时间t的关系曲线如图所示
(1)实验时放出气体总体积是__________
(2)放出一半气体所需的时间约为__________
20、有A,B两个极易导热的容器,A容器的容积不变,B容器的活塞可上、下滑动,保持内外压强相等.在相同条件下,将等物质的量的NO2压入容积相同的A,B两容器中进行反应: 2NO2==N2O4(正反应为放热反应),请用“>”或“<”或“=”填空:
 (1)反应开始时,生成N2O4的速率vA vB;
(1)反应开始时,生成N2O4的速率vA vB;
(2)反应进行中,生成N2O4的速率vA vB;
19、把煤作为燃料可通过下列两种途径:
途径Ⅰ C(s)+O2(g)=====CO2(g);ΔH1<0 ①
途径Ⅱ 先制成水煤气:
C(s)+H2O(g)=====CO(g)+H2(g);ΔH2>0 ②
再燃料水煤气:
2CO(g)+O2(g)=====2CO2(g);ΔH3<0 ③
2H2(g)+O2(g)=====2H2O(g); ΔH4<0 ④
请回答下列问题:
(1)、途径Ⅰ放出的热量理论上_________(填“大于”“等于”或“小于”)途径Ⅱ放出的热量。
(2)、ΔH1、ΔH2、ΔH3、ΔH4的数学关系式是_______________。
(3)、已知:① C(s)+O2(g)=CO2(g); DH=-393.5 kJ·mol-1
② 2CO(g)+O2(g)=2CO2(g); DH=-566 kJ·mol-1
③ TiO2(s)+2Cl2(g)=TiCl4(s)+O2(g); DH=+141 kJ·mol-1
则TiO2(s)+2Cl2(g)+2C(s)=TiCl4(s)+2CO(g)的DH= 。
(4)、已知下列各组热化学方程式
(1)Fe2O3(s)+3CO(g)=2Fe(s)+3CO2 △H=-25kJ/mol
(2)3Fe2O3(s)+CO(g)=2Fe3O4(s)+CO2(g) △H=-47kJ/mol
(3)Fe3O4(s)+CO(g)=3FeO(s)+CO2(g) △H=+640kJ/mol
请写出FeO(s)被CO(g)还原成Fe和CO2(g)的热化学方程式 。
(5)、 在标准状况下的11.2L甲烷完全燃烧生成CO2 和液态水放出444.8KJ热量(298K),其热化学方程式为 已知断裂下列1mol化学键需要吸收的能量分别为:C=O:745KJ/mol , O=O:496kJ/mol , C-H:414KJ/mol 则断裂1molH-O键需要提供的能量为 kJ
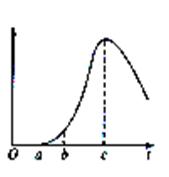
18、把空气中久置的铝片5.0g投入盛有500mL、0.5mol/L的硫酸溶液的烧杯中,该铝片与硫酸反应产生氢气的速率与反应时间可用图所示的坐标曲线来表示。
⑴曲线0→a段不产生H2的原因 ,有关化学方程式为 。
⑵曲线a→c段,产生氢气的速率增加较快的主要原因 。
⑶曲线c段以后,产生氢气的速率逐渐下降的主要原因
17、影响速率的因素:
(1)内因: 。
(2)外因: 、 、固体颗粒大小、光等。
(3)实验室制氢气时,若向稀硫酸中加几滴硫酸铜溶液,则产生氢气的速率加快,该反应中硫酸铜 催化剂(填:是、不是)。
 (4)单独加热氯酸钾,产生氧气的速率小,而将少量高锰酸钾和氯酸钾混合共热制氧气,产生氧气的速率明显加快,该实验中高锰酸钾
催化剂(填:是、不是)。
(4)单独加热氯酸钾,产生氧气的速率小,而将少量高锰酸钾和氯酸钾混合共热制氧气,产生氧气的速率明显加快,该实验中高锰酸钾
催化剂(填:是、不是)。
16.可逆反应:2NO2  2NO+O2在定容密闭容器中反应,达到平衡状态的标志是( )
2NO+O2在定容密闭容器中反应,达到平衡状态的标志是( )
①、单位时间内生成n molO2的同时生成2 nmolNO2,
②、单位时间内生成n molO2的同时生成2 nmolNO
③、用NO2、NO、O2的物质的量浓度变化表示的反应速率之比为2:2:1的状态
④、混合气体的颜色不再改变的状态
⑤、混合气体的密度不再改变的状态
⑥、混合气体的平均相对分子质量不再改变的状态
A、①④⑥ B、 ②③⑤ C、 ①③④ D、①②③④⑤⑥
第Ⅱ卷(非选择题 共52分)
15、以NA代表阿伏加德罗常数,则关于热化学方程式:
C2H4(g)+3 O2=2CO2(g)+ 2 H2O(l);△H=--1300kJ/mol的说法中,正确的是( ) A.有2NA个碳氧共用电子对生成时,放出1300kJ的能量 B.有 NA个水分子生成且为液体时, 吸收1300kJ的能量 C.有12NA个电子转移时,该反应吸收1300kJ的能量 D.有8NA个碳氧共用电子对生成时,放出1300kJ的能量
14、下列说法正确的是( )
A、需要加热才能发生的反应一定是吸热反应 B、放热反应在常温下一定很容易发生 C、放热反应还是吸热反应主要由反应物、生成物所具有的总能量的相对大小决定 D、吸热反应发生过程中要不断从外界获得能量,放热反应不需要外界能量
13、下列方法能增加活化分子百分数的是( )
A.增加某一组分的浓度 B.增体系的大压强
C.降低体系的温度 D.使用合适的催化剂
12、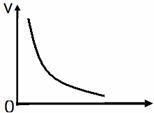 对有气体能加的某化学反应来说,在下图中可能作为横坐标的是( )。 A.温度 B.压强 C.反应物浓度 D.反应时间
对有气体能加的某化学反应来说,在下图中可能作为横坐标的是( )。 A.温度 B.压强 C.反应物浓度 D.反应时间
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com