
题目列表(包括答案和解析)
6、一定条件下,在N2+3H2 2NH3的化平衡体系中,N2、H2、NH3的浓度分别为
2NH3的化平衡体系中,N2、H2、NH3的浓度分别为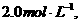
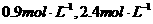 ,若起始时NH3有最大浓度,则起始时N2的浓度为( )
,若起始时NH3有最大浓度,则起始时N2的浓度为( )
A.0 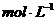 B.3.2
B.3.2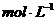 C.
C.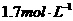 D.无法确定
D.无法确定
5、将等物质的量的A和B混合于2L的密闭容器中,发生如下反应:
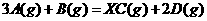 ,经过5
,经过5 后测得D的浓度为
后测得D的浓度为
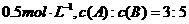 ,C的反应速率为
,C的反应速率为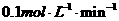 ,下列说法中不正确的是( )
,下列说法中不正确的是( )
A.5 末,A的浓度为
末,A的浓度为
B.0-5 时,B的平均反应速率为
时,B的平均反应速率为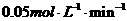
C.B的起始物质的量为1.5mol
D.=2
4、一定条件下,在体积为VL的密闭容器中发生反应: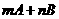
 pC,ts末,A减少了1mol,
B减少了1.5mol,C增加了0.5mol,则下列各关系式正确的是( )
pC,ts末,A减少了1mol,
B减少了1.5mol,C增加了0.5mol,则下列各关系式正确的是( )
A.m=2P B.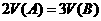 C.
C.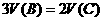 D.3n=P
D.3n=P
3、已知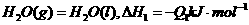
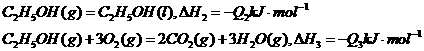
若使46液态乙醇完全燃烧,最后恢复至室温,则放出的热量为( )
A.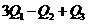 B.
B.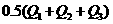
C.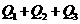 D.
D.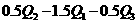 [:]
[:]
2、下列热化方程式中△H表示可燃物燃烧热的是( )
A.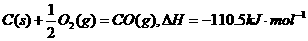
B.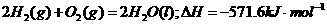
C.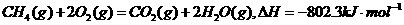
D.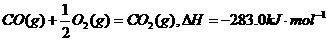
1、下列叙述中正确的是( )
A.化反应一定有物质变化,不一定有能量变化
B.化合反应一定是放热反应
C.放热反应不需要加热就一定能发生
D.吸热反应不加热也可能发生
24.(10分)肼(N2H4)又称联氨,是一种可燃性液体,其燃烧热较大且燃烧产物对环境无污染,故可以用作火箭燃料。
(1)已知:N2(g)+2O2(g)=2NO2(g) △H= +67.7 kJ/mol
2N2H4(l)+2NO2(g)=3N2(g)+4H2O(g) △H= -1135.7 kJ/mol
则肼完全燃烧的热化学方程式为______________________________________________。
(2)肼-空气燃料电池是一种碱性燃料电池,电解质溶液是20%-30%的KOH溶液。该电池放电时,正极的电极反应式是______________________________________,电池工作一段时间后,电解质溶液的pH将_________(填“增大”、“减小”、“不变”)。
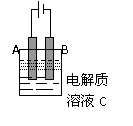 (3)右图是一个电化学装置示意图。用肼--空气燃料电池
(3)右图是一个电化学装置示意图。用肼--空气燃料电池
做此装置的电源。如果A是铂电极,B是石墨电极,C是AgNO3溶液, 若B极增重10.8 g,该燃料电池理论上消耗_____mol N2H4。
(4)肼易溶于水,它是与氨类似的弱碱,用电离方程式表示
肼的水溶液显碱性的原因_________________________________。
[来源:高考%资源网 KS%5U
唐山一中2010~2011学年度第一学期第一次调研考试
23. (12分)二氧化氯(ClO2)是一种在水处理等方面有广泛应用的高效安全消毒剂。与Cl2相比,ClO2不但具有更显著地杀菌能力,而且不会产生对人体有潜在危害的有机氯代物。
(1)在ClO2的制备方法中,有下列两种制备方法:
方法一:2NaClO3+4HCl=2ClO2↑+Cl2↑+2NaCl+2H2O
方法二:2NaClO3+H2O2+H2SO4=2ClO2↑+Na2SO4+O2↑+2H2O
用方法二制备的ClO2更适合用于饮用水的消毒,其主要原因是_________________。
(2)用ClO2处理过的饮用水(pH为5.5~6.5)常含有一定量对人体不利的亚氯酸根离子(ClO2-)。2001年我国卫生部规定,饮用水ClO2-的含量应不超过0.2 mg·L-1。
饮用水中ClO2、ClO2-的含量可用连续碘量法进行测定。ClO2被I-还原为ClO2-、Cl-的转化率与溶液pH的关系如右图所示。当pH≤2.0时,ClO2-也能被I-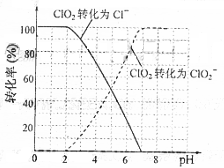 完全还原成Cl-。反应生成的I2用标准Na2S2O3溶液滴定:
完全还原成Cl-。反应生成的I2用标准Na2S2O3溶液滴定:
2Na2S2O3+I2 == Na2S4O6+2NaI
①请写出pH≤2.0时,ClO2-与I-反应的离子方程式 ______________________________________________。
②请完成相应的实验步骤:
步骤1:准确量取V mL水样加入到锥形瓶中。
步骤2:调节水样的pH为7.0~8.0
步骤3:加入足量的KI晶体。
步骤4:加少量淀粉溶液,用c mol·L-1Na2S2O3溶液滴定至终点,消耗Na2S2O3溶液V1 mL。
步骤5:______________________________________________。
步骤6;再用c mol·L-1Na2S2O3溶液滴定至终点,消耗Na2S2O3溶液V2 mL。
③根据上述分析数据,测得该饮用水样中的ClO2-的浓度为__________ mol·L-1(用含字母的代数式表示)。
④若饮用水中ClO2-的含量超标,可向其中加入适量的_________,该反应的氧化产物是 _________还可用于净水(填化学式或离子符号)。
22.(10分)几种短周期元素的原子半径及其某些化合价见下表:
|
元素代号 |
A |
B |
D |
E |
G |
H |
I |
J |
|
常见化合价 |
-1 |
-2 |
+4、-4 |
+6、+4、-2 |
+5、-3 |
+3 |
+2 |
+1 |
|
原子半径/pm |
64 |
66 |
77 |
104 |
110 |
143 |
160 |
186 |
分析上表中有关数据,并结合已学过的知识,回答以下问题,涉及上述元素的答案,请用元素符号表示。
(1)E元素在周期表中位于 周期, 族。
(2) A、H、J对应离子的半径由大到小的顺序是(填离子符号)_______________________________。
(3)A与I所形成的化合物的晶体类型是 。
(4)DB2的电子式__________ 。
(5)D的最高价氧化物与J的最高价氧化物对应水化物X的溶液(足量)发生反应的离子方程式 。
21.(8分)我国农业因遭受酸雨而造成每年损失高达15亿多元。为了有效控制酸雨,目前国务院已批准了《酸雨控制区和二氧化硫污染控制区划分方案》等法规。根据你所学的知识,试回答下列问题:
(1)大气污染物二氧化硫溶于水生成亚硫酸,亚硫酸具有还原性,试写出雨水中亚硫酸被氧化为硫酸的化学方程式__________________________。
(2)某市是受酸雨影响比较严重的城市,电厂每年就要排放二氧化硫9.14万吨。目前该厂应用了国际上最成熟的石灰石-石膏湿法脱硫技术,使每年产生的二氧化硫成倍减少,“变”酸雨为石膏,达到了变废为宝的目的。请写出其中发生的反应中属于分解反应和化合反应的化学方程式各一个。
____________________________________________ 、 ____________________________________________。
(3)结合你所学的化学知识,你认为减少酸雨产生的途径还可采用的措施是___________________________________________________________。
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com