
题目列表(包括答案和解析)
1.关于苯酚的下列说法中,错误的是( )
A.纯净的苯酚是粉红色晶体
B.有特殊气味
C.易溶于乙醇、乙醚等有机溶剂,常温时在水中溶解度不大,温度高于65℃时与水以任意比例混溶
D.苯酚有毒,沾到皮肤上可立即用酒精洗涤;因其有酸性,故也可以用氢氧化钠溶液洗涤
2.以苯为原料,不能通过一步反应而制得的有机物是( )
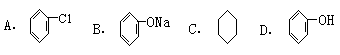 3.能跟Na2CO3溶液反应,但不会放出气体的是(
)
A.苯酚
B.醋酸
C.盐酸
D.CO2
4.某有机物的蒸气完全燃烧时需三倍于其体积的氧气,产生二倍于其体积的CO2,该有机物可能是( )
A.C2H4
B.C2H5OH
C.CH3CHO
D.CH3COOH
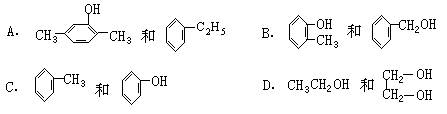
5.下列各组物质互为同分异构体的是( )
3.能跟Na2CO3溶液反应,但不会放出气体的是(
)
A.苯酚
B.醋酸
C.盐酸
D.CO2
4.某有机物的蒸气完全燃烧时需三倍于其体积的氧气,产生二倍于其体积的CO2,该有机物可能是( )
A.C2H4
B.C2H5OH
C.CH3CHO
D.CH3COOH
5.下列各组物质互为同分异构体的是( )
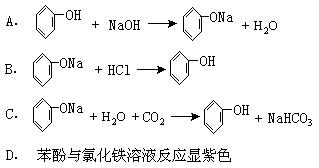
 6.下列反应中,能说明苯酚酸性比碳酸弱的是( )
6.下列反应中,能说明苯酚酸性比碳酸弱的是( )
 7.某有机物中若有一个-C6H5,一个-C6H4-,一个-CH2-,一个-OH,则该有机物属于酚类结构可能有( )
A.二种
B.三种
C.四种
D.五种
8.在下列物质中分别加入FeCl3溶液会显紫色的是(
)
A.CH3CH2CH2OH
B.
7.某有机物中若有一个-C6H5,一个-C6H4-,一个-CH2-,一个-OH,则该有机物属于酚类结构可能有( )
A.二种
B.三种
C.四种
D.五种
8.在下列物质中分别加入FeCl3溶液会显紫色的是(
)
A.CH3CH2CH2OH
B.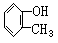 C.
C.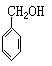 D.
D.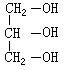 9.下列有关苯酚的叙述中不正确的是( )
A.苯酚是一种弱酸,它能与NaOH溶液反应
B.在苯酚钠溶液中通入CO2气体可得到苯酚
C.除去苯中混有的少量苯酚可用溴水作试剂
D.苯酚有毒,但药皂中掺有少量苯酚
10.长期暴露在空气中,下列物质会因氧化而变质的是( )
A.CH3CH2OH
B.
9.下列有关苯酚的叙述中不正确的是( )
A.苯酚是一种弱酸,它能与NaOH溶液反应
B.在苯酚钠溶液中通入CO2气体可得到苯酚
C.除去苯中混有的少量苯酚可用溴水作试剂
D.苯酚有毒,但药皂中掺有少量苯酚
10.长期暴露在空气中,下列物质会因氧化而变质的是( )
A.CH3CH2OH
B.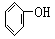 C.FeSO4
D.石灰水
参考答案
1.AD
2.BD 3.AD 4.AB 5.B 6.C 7.B 8.B 9.C 10.BC
C.FeSO4
D.石灰水
参考答案
1.AD
2.BD 3.AD 4.AB 5.B 6.C 7.B 8.B 9.C 10.BC
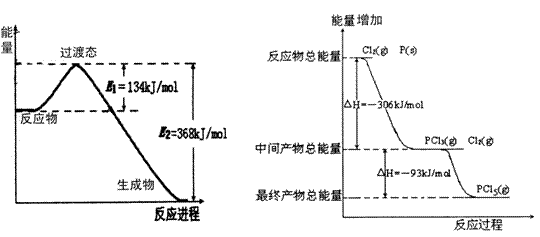
26.(共14分)20世纪30年代,Eyring和Pelzer在碰撞理论的基础上提出化学反应的过渡态理论:化学反应并不是通过简单的碰撞就能完成的,而是在反应物到生成物的过程中经过一个高能量过渡态。分析图(本题最下方)中信息,回答下列问题:
(1)图一是NO2和CO反应生成CO2和NO过程中能量变化示意图,请写出NO2和CO反应的热化学方程式: 。在反应体系中加入催化剂,E1和E2的变化是:E1_________,E2________(填“增大”、“减小”或“不变”),对反应热是否有影响?_______________,原因是_________
。
(2)图二是红磷P(s)和Cl2(g)发生反应生成PCl3(g)和PCl5(g)的反应过程与能量关系图(图中的△H表示生成1mol产物的数据)。根据图二回答下列问题:
① P(s)和Cl2(g)反应生成PCl3(g)的热化学方程式 。
PCl5(g)分解成PCl3(g)和Cl2(g)的热化学方程式 。
② P(s)和Cl2(g)分两步反应生成1molPCl5(g)的△H1与P(s)和Cl2(g)一步反应生成1molPCl5(g)的△H2关系是:△H2______ △H1(填“大于”、“小于”或“等于”),原因是 。




25.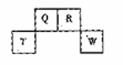 (共10分)短周期元素Q、R、T、W在元素周期表中的位置如右图所示,其中T所处的周期序数与主族序数相等,请回答下列问题:
(共10分)短周期元素Q、R、T、W在元素周期表中的位置如右图所示,其中T所处的周期序数与主族序数相等,请回答下列问题:
(1)元素的非金属性为(原子的得电子能力):Q______W(填“强于”或“弱于”)。
可证明此结论的实验事实是 。
(2)原子序数比R多1的元素是一种氢化物能分解为它的另一种氢化物,
此分解反应的化学方程式是________ __;
若增大化学反应速率,可向溶液中加催化剂 或 。
(3)在298K下,Q、T的单质各1mol完全燃烧,分别放出热量aKJ和bKJ。又知一定条件下,T的单质能将Q从它的最高价氧化物中置换出来,若此置换反应生成3molQ的单质,则该反应在298K下的 =________(注:题中所设单质均为最稳定单质)
=________(注:题中所设单质均为最稳定单质)
24.(共8分)“碘钟”实验中,3I-+S2O82-=I3-+2SO42-的反应速率可以用I3-与加入的淀粉溶液显蓝色的时间t来度量,t越小,反应速率越大。某探究性学习小组在20℃进行实验,得到的数据如下表:
|
实验编号 |
① |
② |
③ |
④ |
⑤ |
|
c(I-)/mol·L- |
0.040 |
0.080 |
0.080 |
0.160 |
0.120 |
|
c(SO42-)/mol·L- |
0.040 |
0.040 |
0.080 |
0.020 |
0.040 |
|
t
/s |
88.0 |
44.0 |
22.0 |
44.0 |
t2 |
回答下列问题:
(1)该实验的目的是 。
(2)显色时间t2= 。
(3)温度对该反应的反应速率的影响符合一般规律,若在40℃下进行编号③对应浓度的实验,显色时间t2的范围为 (填字母)
A <22.0s B 22.0-44.0s C >44.0s D 数据不足,无法判断
(4)通过分析比较上表数据,得到的结论是 。
23.(共9分)某研究小组将V1 mL 1.0 mol/L HCl溶液和V2 mL未知浓度的NaOH溶液混合均匀后测量并记录溶液温度,实验结果如下图所示(实验中始终保持V1+V2=50 mL)。回答下列问题:
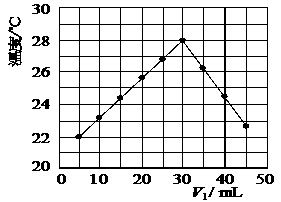
(1)研究小组做该实验时环境温度 (填“高于”、“低于”或“等于”)22 ℃,判断的依据是 。
(2)由题干及图形可知,V1 / V2= 时,酸碱恰好完全中和,此反应所用NaOH溶液的浓度应为 mol/L。
(3)若通过实验测定及有关计算知此反应共放出Q KJ的热量,请写出此反应的热化学方程式:
22. (5分)一定温度下,在体积恒定的密闭容器中,加入A(s)和B(g),进行如下可逆反应:A(s)+2B(g) C(g)+D(g)
(5分)一定温度下,在体积恒定的密闭容器中,加入A(s)和B(g),进行如下可逆反应:A(s)+2B(g) C(g)+D(g)
(1)当下列物理量 (填序号)不发生变化时,能表明该反应已达到平衡状态。
①容器内气体压强 ②混合气的总质量 ③A的质量
④C(g)和D(g)的物质的量之比为1∶1。
(2)当上述反应达到化学平衡后,继续通入一定量的B(g),V(正)将 (填“增大”、“减小”或“不变”),平衡向着 方向移动,达到新平衡后,A(s)质量将 (填“增大”、“减小”或“不变”)。
21.(4分) 火箭推进器中盛有强还原剂液态肼(N2H4)和强氧化剂液态双氧水。当它们混合反应时,即产生大量氮气和水蒸气,并放出大量的热。已知0.4mol液态肼与足量的液态双氧水反应,生成氮气和水蒸气,放出256.652KJ的热量。反应的热化学方程式为 。
20.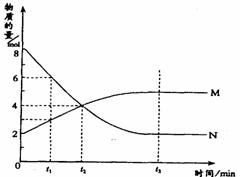 在一定温度下,容器内某一反应中M、N的物质的量随反应时间变化的曲线如图,下列表述中正确的是
在一定温度下,容器内某一反应中M、N的物质的量随反应时间变化的曲线如图,下列表述中正确的是
A.反应的化学方程式为:2M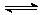 N
N
B.t2时,正逆反应速率相等,达到平衡
C.t3时,正反应速率大于逆反应速率
D.t1时,N的浓度是M浓度的2倍
太 原 五 中
2010-2011年学年度第一学期月考(9月)
高二化学(理)答卷纸
将选择题答案填在下面的表格中
第二卷 非选择题(共50分)
19. 恒温恒容条件下,发生化学反应H2(g)+I2(g) 2HI(g),下列选项中不能作为达平衡标志的是
恒温恒容条件下,发生化学反应H2(g)+I2(g) 2HI(g),下列选项中不能作为达平衡标志的是
A.混合气体颜色不再变化
B.单位时间内生成nmol氢气的同时生成nmol碘蒸气
C.若该反应在隔热密闭体积恒定的容器中进行反应,体系的温度不再变化
D.2V正(H2)= V逆(HI)
18.已知:2CO(g)+O2(g)=2CO2(g) ΔH=-566 kJ/mol
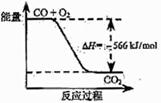 Na2O2(s)+CO2(g)=Na2CO3(s)+
Na2O2(s)+CO2(g)=Na2CO3(s)+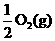 ΔH=-226 kJ/mol
ΔH=-226 kJ/mol
根据以上热化学方程式判断,下列说法正确的是
A.CO的燃烧热为283 kJ
B.右图可表示由CO生成CO2的反应过程和能量关系
C.2Na2O2(s)+2CO2(s)= 2Na2CO3(s)+O2(g) ΔH>-452 kJ/mol
D.CO2(g)与Na2O2(s)反应放出509 kJ热量时,电子转移数为6.02×1023
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com