
题目列表(包括答案和解析)
5.下列物质中属于非电解质的是
A.NaOH B.O2 C.Na2CO3 D.乙醇
4.下列类型的化学反应也一定是氧化还原反应的是
A.化合反应 B.分解反应 C.置换反应 D.复分解反应
3. Na2CO3俗名纯碱,下面是对纯碱采用不同分类法的分类,不正确的是
Na2CO3俗名纯碱,下面是对纯碱采用不同分类法的分类,不正确的是
A.Na2CO3是碱 B.Na2CO3是盐 C.Na2CO3是钠盐 D.Na2CO3是碳酸盐
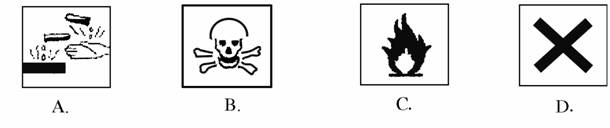
2.在盛放浓硫酸的试剂瓶的标签上应印有下列警示标记中的是
1.下面是人们对于化学科学的各种常见认识,其中错误的是
A.化学将在能源、资源的合理开发和安全应用方面大显身手
B.化学是在被运用于破坏环境而没有治理环境污染
C.化学是一门具有极强实用性的科学
D.化学是一门以实验为基础的自然科学
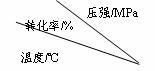
34.(9分)工业上生产硫酸时,利用催化氧化反应将SO2 转化为SO3是一个关键步骤。压强及温度对SO2转化率的影响如下表(原料气各成分的体积分数为:SO2 7%,O2 11%,N2 82%);
 |
0.1 |
0.5 |
1 |
10 |
|
400 |
99.2 |
99.6 |
99.7 |
99.9 |
|
500 |
93.5 |
96.9 |
97.8 |
99.3 |
|
600 |
73.7 |
85.8 |
89.5 |
96.4 |
(1)利用表中数据推断SO2的氧化是 (填“吸热”或“放热”)反应;
(2)在400~500℃时,SO2的催化氧化采用 (填“常压”或“高压”);
(3)选择适宜的催化剂,是否可以提高SO2的转化率? (填“是”或“否”),是否可以增大该反应所放出的热量? (填“是”或“否”);
(4)为提高SO3吸收率,实际生产中用 吸收SO3;
(5)已知:2SO2(g)+O2(g)=2SO3(g);△H=-196.6kJ·mol-1,计算每生产1万吨98%硫酸所需要的SO3质量和由SO2生产这些SO3所放出的热量。
、
33、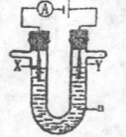 (15分)(1) 电解原理在化学工业中有广泛的应用。现将你设计的原电池通过导线与图中电解池相连,其中a为电解液,X和Y是两块电极扳,则
(15分)(1) 电解原理在化学工业中有广泛的应用。现将你设计的原电池通过导线与图中电解池相连,其中a为电解液,X和Y是两块电极扳,则
①若X和Y均为惰性电极,a为饱和食盐水,则电解时检验Y电极反应产物的方法是 。
②若X、Y分别为石墨和铁,a仍为饱和的NaCl溶液,则电解过程中会生成白色固体,发生的总反应化学方程式为
 。
。
该白色固体露置在空气中,可观察到的现象是
。
③ 若X和Y均为惰性电极,a为一定浓度的硫酸铜溶液,通电后,发生的总反应化学方程式为
若X和Y均为惰性电极,a为一定浓度的硫酸铜溶液,通电后,发生的总反应化学方程式为
 。通电一段时间后,向所得溶液中加入0.05 mol Cu(OH)2,恰好恢复电解前的浓度和pH,则电解过程中电子转移的物质的量为
mol。高☆考♂资♀源*网
。通电一段时间后,向所得溶液中加入0.05 mol Cu(OH)2,恰好恢复电解前的浓度和pH,则电解过程中电子转移的物质的量为
mol。高☆考♂资♀源*网
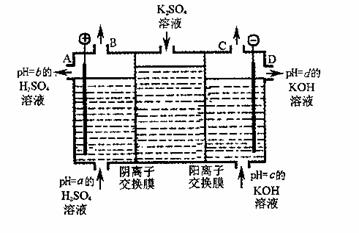 (2)利用工业上离子交换膜法制烧碱的原理,用如图所示装置电解K2SO4溶液。
(2)利用工业上离子交换膜法制烧碱的原理,用如图所示装置电解K2SO4溶液。
① 该电解槽的阳极反应式为
,通过阴离子交换膜的离子数 (填“>”、“<”或“=”)通过阳离子交换膜的离子数;
② 图中a、b、c、d分别表示有关溶液的pH,则a、b、c、d由小到大的顺序为 ;
③ 电解一段时间后,B口与C口产生气体的质量比为 。
32.(10分)A、B、C、D、E均为可溶于水的固体,所得的溶液只有E溶液有颜色。取一定量的固体C放在试管中用酒精灯加热,固体的质量会减少。组成这五种物质的离子有(各物质所含的离子均不相同)
|
阳离子 |
Na+ Mg2+ Al3+ Ba2+ Fe3+ |
|
阴离子 |
OH- Cl- CO32- SO42- HCO32- |
分别取它们的水溶液进行实验,结果如下:
①A溶液分别与其他四种反应,均有沉淀;
②B溶液分别与其他四种溶液反应,也有沉淀;只有当B溶液加入到D溶液中时,先有沉淀,继续加入B溶液时,沉淀会消失。
据此推断它们是:A ;B ;C ;D ;E 。
31.(6分)(1)1.00L1.00mol/LH2SO4溶液与2.00L1.00mol/LNaOH溶液完全反应,放出114.6kJ的热量,表示其中和热的热化学方程式为 。
(2)由金红石(TiO2)制取单质Ti,涉及到的步骤为:
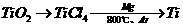
已知:①C(s) + O2(g) = CO2(g);ΔH=-393.5kJ/mol
②2CO(g) + O2(g) = 2CO2(g);ΔH=-566kJ/mol
③TiO2(s) + 2Cl2(g) = TiCl4(s)+O2(g);ΔH=+141kJ/mol
则(1)碳在氧气中不完全燃烧生成CO的热化学方程式为
。
(2)TiO2(s) + 2Cl2(g) + 2C(s) = TiCl4(s) + 2CO(g)的ΔH=________________。
30、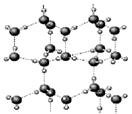 右图为冰晶体的结构模型,大球代表O原子,小球代表H原子。
右图为冰晶体的结构模型,大球代表O原子,小球代表H原子。
下列有关说法正确的是( )
A.冰晶体熔化时,水分子之间的空隙增大
B.冰晶体具有空间网状结构,是原子晶体
C.水分子间通过H-O键形成冰晶体
D.冰晶体中每个水分子与另外四个水分子形成四面体
班级 姓名 学号 得分
第II卷(40分)
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com