
题目列表(包括答案和解析)
1.我们主要从三个方面讨论一个化学反应的原理,其中不属于这三个方面的是( )
A、反应进行的方向 B、反应的快慢 C、反应进行的限度 D、反应物的多少
29.(12分)在一定温度下,将2mol A和2molB 两种气体相混合于容积为2L的某密闭容器中,发生如下反应:3A(g)+B(g)  xC(g)+2D(g),2分钟末反应达到平衡状态,生成了0.8mol D,并测得C的浓度为0.4
mol·L-1,请填写下列空白:
xC(g)+2D(g),2分钟末反应达到平衡状态,生成了0.8mol D,并测得C的浓度为0.4
mol·L-1,请填写下列空白:
(1)A的转化率为________;
(2)2分钟内生成D的反应速率为____________;
(3)x值等于________________;
(4)如果增大反应体系的压强,则平衡体系中C的质量分数________(填“增大”“减小”或“不变”)
28.(14分)现有反应:mA(g)+nB(g) pC(g),达到平衡后,当升高温度时,B的转化率变大;当减小压强时,混合体系中C的质量分数减小,则:
pC(g),达到平衡后,当升高温度时,B的转化率变大;当减小压强时,混合体系中C的质量分数减小,则:
(1)该反应的逆反应为_________反应(填“吸热”或“放热”),且m+n_________p(填“>”“=”“<”)。
(2)减压使容器体积增大时,A的质量分数_________。(填“增大”“减小”或“不变”,下同)
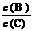 (3)若加入B(维持体积不变),则A的转化率_________。
(3)若加入B(维持体积不变),则A的转化率_________。
(4)若升高温度,则平衡时B、C的浓度之比 将_________。
(5)若加入催化剂,平衡时气体混合物的总物质的量____ _____。
(6)若B是有色物质,A、C均无色,则加入C(容器体积不变)时混合物颜色______ _;
27.(8分)对于3H2(气)+N2(气) 2NH3(气)(正反应方向为放热),若使平衡正向移动,可采取的措施是 氮气或 氨气、 温度、
压强
2NH3(气)(正反应方向为放热),若使平衡正向移动,可采取的措施是 氮气或 氨气、 温度、
压强
26.(5分)利用盖斯定律回答下列问题:
已知热化学方程式 C(s、金刚石)+O2(g)== CO2(g); △H= -395.4kJ·mol-1
C(s、石墨)+O2(g) == CO2(g); △H= -393.5kJ·mol-1
请写出由金刚石转化为石墨的热化学方程式为 ,
25.(5分)已知下列热化学反应方程式:
①Fe2O3(s)+3CO(g)=2Fe(s)+3CO2(g) ΔH1=-25kJ/mol
②3Fe2O3(s)+ CO(g)== 2Fe3O4(s)+CO2(g) ΔH2 =-53kJ/mol
③Fe3O4(s)+CO(g)==3FeO(s)+CO2(g) ΔH3= + 19kJ/mol
试写出CO气体还原FeO固体得到Fe固体和CO2气体的热化学反应方程式:
。
24、(10分)己知H2(g)+1/2O2(g)==H2O(g)反应过程中能量变化如图,
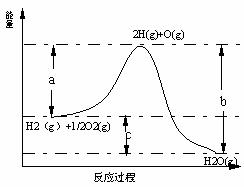
其中a、b、c分别代表 、 、
。该反应是 反应(填“放热”或“吸热”)△H 0(填“大于”或“小于”)。
23.设C+CO2  2CO ΔΗ1>0,反应速率为V1 ;N2+3H2
2CO ΔΗ1>0,反应速率为V1 ;N2+3H2  2NH3 ΔΗ2<0,反应速率为V2,对于上述反应,当温度升高时,υ1和υ2的变化情况为
2NH3 ΔΗ2<0,反应速率为V2,对于上述反应,当温度升高时,υ1和υ2的变化情况为
A.同时增大 B.同时减少 CV1增大,V2减小 D.V1减小,V2增大
第Ⅱ卷(非选择题 共54分)
22.100mL6mol/LH2SO4与过量锌粉反应,一定温度下,为了减缓反应进行的速率,但又不影响 生成氢气的总量,可向反应物中加入适量的
A.硫酸钠固体 B. 7mol/L H2SO4溶液 C.硫酸钾溶液 D.氢氧化钠固体
21.含1 mol Ba(OH)2 的稀溶液与足量稀盐酸反应,放出114.6 kJ的热量,表示该反应中和热的热化学方程式正确的是
A.Ba(OH)2(aq)+2HCl(aq)==BaCl2(aq)+2H2O(l);ΔH=-114.6 kJ/mol
B.Ba(OH)2(aq)+2HCl(aq)==BaCl2(aq)+2H2O(l);ΔH=+114.6 kJ/mol
C.1/2Ba(OH)2(aq)+HCl(aq)== 1/2 BaCl2(aq)+H2O(l);ΔH= -57.3 kJ/mol
D.1/2Ba(OH)2(aq)+HCl(aq)== 1/2BaCl2(aq)+H2O(l);ΔH=+57.3 kJ/mol
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com