
题目列表(包括答案和解析)
28.(14分)草酸晶体的组成可表示为:H2C2O4·XH2O,为测定X值,进行下列实验:
①称取wg草酸晶体配成100.0mL水溶液;
②取25.0mL所配草酸溶液置于锥形瓶中,加入适量稀H2SO4后,用浓度为cmol·LKMnO4
溶液滴定。
请回答下列问题:
(1)实验①中为配制准确浓度的草酸溶液,所需用到的仪器是:天平(含砝码)、烧杯、药匙、玻璃棒、胶头滴管和 。
(2)实验②中,滴定时,KMnO4溶液应装在 (填“酸式滴定管”、“碱式滴定管”,原因是 。
(3)滴定中,目光应注视 ,判断滴定结束的标准是 。读数时,目光应与凹液面的最 (填“上”、“下”)端水平。
(4).滴定时,所发生的反应为:已知H2C2O4 碳元素化合价为+3,配平化学反应方程式
( )KMnO4+( )H2C2O4+( )H2SO4= ( )K2SO4+( )CO2↑+( )MnSO4+( )H2O
(5)假设滴定终点时,用去VmL KMnO4溶液,则待测草酸的物质的量浓度为 mol·L-1。
附加题:(10分)
27.(10分)(1)将等体积等物质的量浓度的醋酸和氢氧化钠溶液混合后,溶液呈 (填“酸性、中性、碱性”)原因是 (用离子方程式表示)
(2)pH=3的醋酸和pH=11的氢氧化钠溶液等体积混合后溶液呈 ,溶液中c(Na+) c(CH3COO-) (填“大于”、“小于”、“等于”)
(3)物质的量浓度相同的醋酸和氢氧化钠溶液混合后,溶液中醋酸根离子和钠离子浓度相等,则混合后溶液呈 ,(填“酸性”、“碱性”、“中性”),醋酸体积
氢氧化钠溶液体积。(填“大于”、“小于”、“等于”)
26. (4分)向25mL
0.1 mol·L-1 NaOH溶液中逐滴滴加0.2 mol·L-1 HCl溶液进行中种滴定。请回答:
(4分)向25mL
0.1 mol·L-1 NaOH溶液中逐滴滴加0.2 mol·L-1 HCl溶液进行中种滴定。请回答:
(1).图II表示50mL滴定管中液面的位置,如果液面处的读数是a ,则滴定管中液体的体积(填代号)______________。 A. 是amL B.是(50-a)mL C. 一定大于amL D.一定大于(50-a)mL
(2).关于该滴定实验,从下列选项中选出最恰当的一项 (选填字母)

|
25.(4分)向50mL0.018mol/L的AgNO3溶液中加入50mL0.020mol/L的盐酸,生成沉淀。如果溶液中c(Ag+)、c(Cl-)乘积一个常数:c(Ag+)·c(Cl-)=1.0×10-10,试求:
(1)沉淀生成后溶液中c(Ag+)为 ;
(2)沉淀生成后溶液的PH是 。
24.(12分)现有NH4+、Al3+、 Na+、SO42-、AlO2-、Fe3+、HCO3-、Cl-等离子,请按要求填空:
(1)在水溶液中,该离子水解呈碱性的是 。
(2)在水溶液中,该离子水解呈酸性的是 。
(3)既能在酸性较强的溶液里大量存在,又能在碱性较强的溶液里大量存在的离子有 。
(4)既不能在酸性较强的溶液里大量存在,又不能在碱性较强的溶液里大量存在的离子有 。
23.在25 mL 0.1 mol/L NaOH溶液中逐滴加入0.2 mol/L
CH3COOH溶液,曲线如下图所示,有关粒子浓度关系比较正确的
A.在A、B间任一点,溶液中一定都有:c(CH3COO-) > c(Na+) > c(OH-) > c(H+)
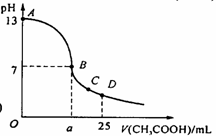 B.在B点,a > 12.5,且有
B.在B点,a > 12.5,且有
c(Na+) = c(CH3COO-) = c(OH-) = c(H+)
C.在C点:c(CH3COO-) > c(Na+) > c(H+) > c(OH-)
D.在D点:c(CH3COO-) + c(CH3COOH) = 2c(Na+)
II 非选择题(共44分)
22.一种常用的泡沫灭火器构造如下图。内筒a是玻璃瓶,外筒b是钢瓶,平时泡沫灭火器内筒外筒盛有液态试剂,当遇火警时,将灭火器取下倒置,内外筒液体试剂立即混合产生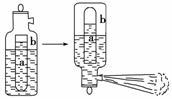 大量CO2泡沫灭火,从液态试剂在灭火器中长久放置和快速灭火两个角度分析,盛放药品正确的是
大量CO2泡沫灭火,从液态试剂在灭火器中长久放置和快速灭火两个角度分析,盛放药品正确的是
A.a中盛饱和Na2CO3溶液,b中盛Al2(SO4)3溶液
B.a中盛饱和NaHCO3溶液,b中盛Al2(SO4)3溶液
C.a中盛Al2(SO4)3溶液,b中盛饱和Na2CO3溶液
D.a中盛Al2(SO4)3溶液,b中盛饱和NaHCO3溶液
21.广义的水解观认为,无论是盐的水解还是非盐的水解,其最终结果是反应中各物质和水分别解离成两部分,然后两两重新组合成新的物质。根据上述观点下列说法不正确的是
A.CaO2的水解产物是Ca(OH)2和H2O2 B.NaClO的水解产物之一是HClO
C.PCl3的水解产物是PH3和HClO D.Mg3N2水解生成NH3和Mg(OH)2
20.
常温下,0.1
mol/L某一元酸(HA)溶液中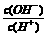 =1×10-8,下列叙述正确的是
=1×10-8,下列叙述正确的是
A.溶液中水电离出的c(H+)=10-10 mol/L
B.溶液中c(H+)+c(A-)=0.1 mol/L
C.溶液中加入一定量NaA晶体或加水稀释,溶液的c(OH-)均增大
D.与0.05mol/L NaOH溶液等体积混合后所得溶液中离子浓度大小关系为
c(A-)>c(Na+)>c(OH-)>c(H+)
19.将pH=11 NaOH溶液和pH=3的次氯酸溶液以等体积混合后,对所得溶液,下列
判断一定正确的是
A.c(ClO-)< c(Na+) B.c(ClO-)> c(Na+)
C.c(OH-)< c(ClO-) D.c(OH-)> c(ClO-)
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com