
题目列表(包括答案和解析)
3. 反应2A(g) 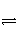 2B(g) + E(g)(正反应为吸热反应)达到平衡时,要使正反应速率降低,
A的浓度增大,应采用的措施是
2B(g) + E(g)(正反应为吸热反应)达到平衡时,要使正反应速率降低,
A的浓度增大,应采用的措施是
A. 加压 B. 减压 C. 减小E的浓度 D. 降温
2.下列能用勒夏特列原理解释的是
A.Fe(SCN)3溶液中加入固体KSCN后颜色变深
B.工业上由氢气和氮气合成氨是在较高温度下进行的
C.SO2催化氧化成SO3的反应,往往需要使用催化剂
D.H2、I2、HI平衡混和气加压后颜色变深
1.在2A+B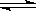 3C+4D反应中,表示该反应速率最快的是
3C+4D反应中,表示该反应速率最快的是
A.υ(A)= 0.5 mol/(L·s) B.υ(B)= 0.3 mol/(L·s)
C.υ(C)= 0.8 mol/(L·s) D.υ(D)= 1 mol/(L·s)
21.(附加题10分,可不做不计入总分),工业上处理含Cr2O72-的酸性工业废水用以下方法:①往工业废水中加入适量的NaCl,搅拌均匀;②用Fe为电极进行电解,经过一段时间有Cr(OH)3和Fe(OH)3沉淀生成,③过滤回收沉淀,废水达排放标准,试回答:
(1)电解时的电极反应,阳极_______________________,阴极_____________________。
(2)写出Cr2O72-转变成Cr3+的离子反应__________________________________________
(3)电解过程中Cr(OH)3和Fe(OH)3沉淀是怎样产生的?
________________________________________________________________________
(4)能否将Fe电极改成石墨电极?为什么?
________________________________________________________________________
20、(10)已知电极材料:铁、铜、银、石墨、锌、铝,电解质溶液:氯化铜溶液、硫酸铁溶液、盐酸。按要求回答下列问题:
(1)电工操作上规定:不能把铜导线和铝导线连接在一起使用,请说明原因。__________。
(2)若电极材料选铜和石墨,电解质溶液选硫酸铁溶液,外加导线,能否构成原电池? ,若能,请写出电极反应式,负极 ,正极 。若不能后面两空不填。
(3)若电池反应为:Cu+2H+= Cu2++H2,该电池属于原电池还是电解池?请画出该装置示意图并注明电极材料和电解质溶液。
19.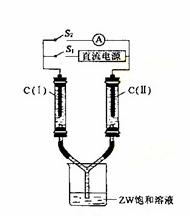 (10分)X、Y、Z、W为按原子序数由小到大排列的四种短周期元素。已知:
(10分)X、Y、Z、W为按原子序数由小到大排列的四种短周期元素。已知:
① X可分别与Y、W形成X2Y、X2Y2、XW等共价化合物;
② Z可分别与Y、W形成Z2Y、Z2Y2、ZW等离子化合物。
请回答:
(1)Z2Y的化学式是 ,
(2)如图所示装置,两玻璃管中盛满滴有酚酞的溶液的ZW和溶液,C(Ⅰ)、C(Ⅱ)为多孔石墨电极。接通S1 后,C(Ⅰ)附近溶液变红,两玻璃管中有气体生成。一段时间后(两玻璃管中液面未脱离电极),断开S1,接通S2,电流表的指针发生偏转。此时:
C(Ⅰ)的电极名称是 (填写正极或负极);电极反应式是: ;
C(Ⅱ)的电极反应式是 。
(3)铜屑放入稀硫酸不发生反应,若在稀硫酸中加入X2Y2,铜屑可逐渐溶解,该反应的离子方程式是: 。
18.(6分)已知250C、101kPa时下列反应的热化学方程式为:
①CH3COOH(l)+2O2(g)=2CO2(g)+2H2O(l)△H=-870.3kJ/mol
②C(s)+O2(g)=CO2(g) △H=-393.5kJ/mol
③H2(g) + 1/2O2(g) = H2O(l) 的△H=-285.8kJ/mol
试计算反应2C(s)+2H2(g) +O2(g)=CH3COOH(l)在该条件下的反应热△H
17.(6分)红磷 P (s)和 Cl2(g)发生反应生成 PCl3(g)和 PCl5(g)。反应过程和能量关系如图所示(图中的△H表示生成 l mol 产物的数据)。
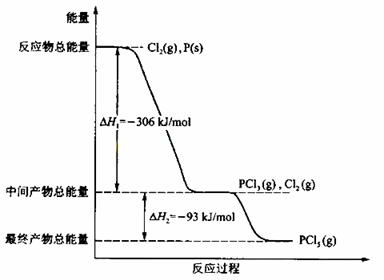 根据上图回答下列问题:
根据上图回答下列问题:
(1)P和CI2反应生成PC13的热化学方程式是 。
(2)PC15分解成 PC13和Cl2的热化学方程式是 ;
16.(8分)已知下列热化学方程式:①H2(g) +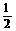 O2
(g) =H2O(l);ΔH=-285 kJ·mol-1
O2
(g) =H2O(l);ΔH=-285 kJ·mol-1
②H2(g) +1/2 O2 (g) =H2O(g);ΔH=-241.8 kJ·mol-1
③C(s) +1/2 O2 (g) =CO(g);ΔH=-110.5 kJ·mol-1
④ C(s) +O2 (g) =CO2(g);ΔH=-393.5 kJ·mol-1
回答下列问题:
(1)H2的燃烧热为 ;C的燃烧热为 。
(2)燃烧1gH2生成液态水,放出的热量为 。
(3)写出CO燃烧的热化学方程式 。
15.已知热化学方程式:
H2O(g)=H2(g) + O2(g) △H = +241.8kJ/mol
H2(g)+ O2(g) = H2O(1) △H = -285.8kJ/mol
当1g液态水变为水蒸气时,其热量变化是 ( )
A.吸热88kJ B. 吸热2.44KJ
C.放热44kJ D. 吸热44KJ
Ⅱ卷
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com