
题目列表(包括答案和解析)
3、下列关于铜电极的叙述不正确的是( )
A、铜锌原电池中铜是正极 B、用电解法精炼铜时粗铜作阳极
C、在镀件上镀铜时可用铜作阳极 D、电解稀H2SO4制H2、O2时铜做阳极
2.已知H2(g)+Cl2(g)=2HCl(g) △H= ―184.6kJ·mol-1,
则反应HCl(g)=1/2H2(g)+1/2Cl2(g)的△H为 ( )
A.+184.6kJ·mol-1 B.―92.3kJ·mol-1
C.+92.3kJ D. +92.3kJ·mol-1
1.未来新能源的特点是资源丰富,在使用时对环境无污染或污染很小,且可以再生。下列属于未来新能源标准的是( )
①天然气 ②煤 ③核能 ④石油 ⑤太阳能 ⑥生物质能 ⑦风能 ⑧氢能
A.①②③④ B.⑤⑥⑦⑧ C.③⑤⑥⑦⑧ D.③④⑤⑥⑦⑧
26.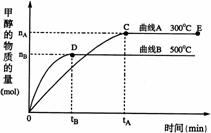 (10分)一定条件下,在体积为3 L的密闭容器中,一氧化碳与氢气反应生成甲醇(催化剂为Cu2O/ZnO):
(10分)一定条件下,在体积为3 L的密闭容器中,一氧化碳与氢气反应生成甲醇(催化剂为Cu2O/ZnO):
CO(g)+2H2(g)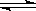 CH3OH(g)
CH3OH(g)
根据题意完成下列各题:
(1)反应达到平衡时,平衡常数表达式K= ,升高温度,K值 (填“增大”、“减小”或“不变”)。
(2)在500℃,从反应开始到平衡,氢气的平均反应速率v(H2)=
(3)在其他条件不变的情况下,对处于E点的体系体积压缩到原来的1/2,下列有关该体系的说法正确的是(填序号)
a 氢气的浓度减少 b 正反应速率加快,逆反应速率也加快
c 甲醇的物质的量增加 d 重新平衡时n(H2)/n(CH3OH)增大
(4)据研究,反应过程中起催化作用的为Cu2O,反应体系中含少量CO2有利于维持催化剂Cu2O的量不变,原因是: (用化学方程式表示)
会昌中学2010-2011学年上学期第一次月考高二化学试题
25.(5分)有A、B、C、D、E五种溶液,其中的阳离子分别是Ag+、Na+、Ba2+、Al3+、Fe3+,阴离子分别为Cl-、OH-、NO3-、CO32-、SO42-(都不重复),现进行如下实验:
(1)C溶液中加入纯铁粉,溶液质量增加;
(2)A、E溶液都呈碱性,测得0.1mol/L的A溶液pH小于0. 1mol/L的E溶液;
(3)在B溶液中逐滴加入氨水,出现沉淀,继而沉淀消失;
(4)在D溶液中加入硝酸钡溶液,无明显现象。
据此推断各溶液的成分(填溶质的化学式):
A为 ;B为 ;C为__________;D为 ;E为
24.(4分)可逆反应2A(g) 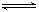 B(g)(放热反应)从反应开始至建立平衡后改变某一外界条件(外界条件指的是温度、压强、浓度和催化剂)使平衡发生了移动至新的平衡,该过程中各物质的浓度(用c表示)随时间变化情况如下图所示,试分析各图,指出导致平衡移动的因素和平衡移动的方向:
B(g)(放热反应)从反应开始至建立平衡后改变某一外界条件(外界条件指的是温度、压强、浓度和催化剂)使平衡发生了移动至新的平衡,该过程中各物质的浓度(用c表示)随时间变化情况如下图所示,试分析各图,指出导致平衡移动的因素和平衡移动的方向:
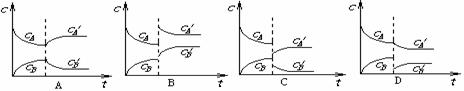
|
序号 |
平衡移动的因素 |
平衡移动的方向 |
|
A |
|
|
|
B |
|
|
|
C |
|
|
|
D |
|
|
23.(14分)用 NH4Cl进行如下实验,试判断发生的现象,并简单说明原因。
(1)用玻璃棒蘸取少量 NH4Cl溶液与pH试纸接触时,试纸显示的颜色与标准比色卡相比,可发现 NH4Cl的pH 7(填“<”、“=”或“>”),显 性(填“酸”、“碱”或“中”),其原因可用离子方程式表示为 ;
(2)在NH4Cl溶液中加入镁粉,可观察到有气体生成,其主要成分为 。
(3)若对NH4Cl溶液进行测定,溶液中浓度最大的是 离子,微粒个数最少的是 离子。
(4)25℃时,向0.1mol/L的氨水中加入少量氯化铵固体,当固体溶解后,测得溶液pH减小,主要原因是(填序号) 。
A.氨水与氯化铵发生化学反应
B.氯化铵溶液水解显酸性,增加了c(H+)
C.氯化铵溶于水,电离出大量铵离子,抑制了氨水的电离,使c(OH―)减小
(5)室温下,如果将0.1mol NH4Cl和0.05mol NaOH全部溶于水,形成混合溶液(假设无损失),
① 和 两种粒子的物质的量之和等于0.1mol。
②_ __和_ 两种粒子的物质的量之和比OH―多0.05mol。
22.(4分)由氢气和氧气反应生成1mol水蒸气放热241.8kJ,若1g水蒸气转化成液态水时放热2.444KJ,试写出氢气的燃烧热的热化学方程式--------------------------------------。
21.(3分)浓度均为0.1 mol/L的溶液:①HNO3; ②H2SO4; ③CH3COOH; ④Ba(OH)2; ⑤NaOH;⑥CH3COONa;⑦KCl;⑧NH4Cl;⑨NH3·H2O;⑩NaHCO3;溶液的pH由小到大的顺序是: 。(填编号)
20.25℃时,将稀氨水逐滴加入到稀硫酸中,当溶液的pH=7时,下列关系正确的是( )
A.c(NH4+)=c(SO42-) B.c(NH4+)>c(SO42-)
C.c(NH4+)<c(SO42-) D.c(OH-)+c(SO42-) = c(NH4+)+c(H+)
二、填空题(40分)
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com