
题目列表(包括答案和解析)
21.(14分)二氧化氯(ClO2)作为一种高效强氧化剂已被联合国世界卫生组织(WHO)列为AI级安全消毒剂。常温下二氧化氯为黄绿色或橘黄色气体,性质非常不稳定,温度过高或水溶液中ClO2的质量分数高于30%等均有可能引起爆炸,易与碱液反应生成盐和水。
(1)某研究小组设计如图所示实验制备ClO2溶液,其反应的化学方程式为


①在反应开始之前将烧杯中的水加热到80℃,然后停止加热,并使其温度保持在60-80℃之间。控制温度的目的是 ,图示装置中缺少的一种必须的玻璃仪器是
②装置A用于溶解产生的二氧化氯气体,其中最好盛放 (填字母)。
A.20mL 60℃的温水 B.100mL冰水
C.100mL饱和食盐水 D.100mL沸水
③在烧瓶中加入12.25g KClO3和9g草酸(H2C2O4),然后再加入足量的稀硫酸,水浴加热,反应后生成ClO2的质量为
(2)用ClO2处理过的饮用水(pH为5.5-6.5)常含有一定量对人体不利的亚氯酸根离子(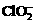 )。饮用水中ClO2、
)。饮用水中ClO2、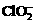 的含量可用连续碘量法进行测定,实验步骤如下:
的含量可用连续碘量法进行测定,实验步骤如下:
步骤1:准确量取一定体积的水样加入锥形瓶中;
步骤2:调节水样的pH至7.0-8.0;
步骤3:加入足量的KI晶体;
步骤4:加入少量指示剂,用一定浓度的Na2S2O3溶液滴定至终点;
步骤5:再调节溶液的pH≤2.0;
步骤6:继续用相同浓度的Na2S2O3溶液滴定至终点。
①步骤1中若要量取20.00mL水样,则应选用的仪器是
②步骤1-4的目的是测定水样中ClO2的含量,其反应的化学方程式为:
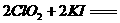
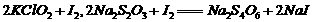 ,则步骤4中加入的指示剂为 ,滴定达到终点时溶液的颜色变化为
,则步骤4中加入的指示剂为 ,滴定达到终点时溶液的颜色变化为
③步骤5的目的是使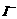 将溶液中的
将溶液中的 还原为
还原为 以测定其含量,该反应的离子方程式为:
以测定其含量,该反应的离子方程式为:
④若饮用水中 的含量超标,可向其中加入适量的
的含量超标,可向其中加入适量的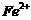 将
将 还原为
还原为 ,则该反应的氧化产物为
(填化学式)
,则该反应的氧化产物为
(填化学式)
20.(4分)(1) 玻璃棒在中学化学实验中一般有如下三种用途:搅拌、引流和蘸取溶液。下列实验中至少用到其中两个用途的是 (填代号)。
① 配制一定物质的量浓度的溶液 ② 硫酸铜晶体里结晶水含量的测定
 ③ 用硫酸铜晶体和氢氧化钠溶液制取氧化铜 ④ 测定某溶液的pH
③ 用硫酸铜晶体和氢氧化钠溶液制取氧化铜 ④ 测定某溶液的pH
⑤ 从草木灰(主要成分碳酸钾)中提取钾盐 ⑥浓盐酸与浓氨水相遇发烟
(2)某天然碱的化学组成可能为aNa2CO3·bNaHCO3·cH2O (a、b、c为正整数),为确定其组成,化学兴趣小组的同学进行了如下实验:取少量天然碱样品放入试管中,用酒精灯加热,在试管口有液体生成,该液体能使无水硫酸铜变蓝。能否说明样品中含结晶水,试简述理由
17.(8分)四川多产五倍子,以五倍子为原料可制得化合物A,A的结构简式如右图所示:
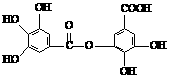 (1)1molA最多可与
mol NaOH反应。
(1)1molA最多可与
mol NaOH反应。
(2)A不具有的性质是 (填写序号)。
①与FeCl3溶液发生显色反应 ②加聚反应
③与溴水发生取代反应 ④与碳酸氢钠溶液反应生成二氧化碳
⑤与溴水发生加成反应
(3)有机化合物B在浓硫酸催化条件下加热发生酯化反应可得到A。请写出B的结构简式
(4)有机化合物C是合成治疗禽流感药物的原料之一,C可以看成是B与氢气按物质的量之比
1:2发生加成反应得到的产物。C分子中无羟基与碳碳双键直接相连的结构,它能与溴水反应使溴水褪色。请写出C与溴水反应的化学方程式:
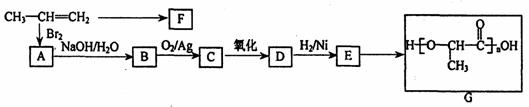 18.(8分)工业上由丙烯经下列反应可制得F、G两种高分子化合物,它们都是常用的塑料。
18.(8分)工业上由丙烯经下列反应可制得F、G两种高分子化合物,它们都是常用的塑料。
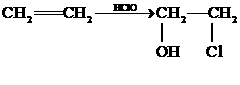
已知:
请回答下列问题:
(1)烷烃A只有2种同分异构体(包括A),则A的分子式是
(2)B和G均为一氯代烃,B发生消去反应时,有C和C′两种有机产物,而G发生消去反应时,只有一种有机产物C′。则C和C′的名称(系统命名)分别为 ,
(3)反应D→E的化学方程式为
(4) 乙偶姻F的结构简式为
(5)任意写出2种能发生水解反应的乙偶姻的同分异构体的结构简式:
16、将x mol Al2O3和y mol CuO混合后,全部溶于V L过量的稀硫酸中,然后向溶液中逐渐加入0.5 mol/L的NaOH溶液,当加入a L时,生成的沉淀最多,则原稀H2SO4的物质的量浓度为
A. mol/L B.
mol/L B.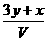 mol/L C.
mol/L C.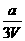 mol/L D.无法计算
mol/L D.无法计算
第II卷 非选择题(共52分)
15、某有机物A 是农药生产中的一种中间体,其结构简式如下。下列叙述中正确的是
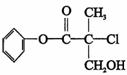 A.有机物A 属于芳香烃
B.有机物A 可以与Br2的CCl4溶液发生加成反应
A.有机物A 属于芳香烃
B.有机物A 可以与Br2的CCl4溶液发生加成反应
C.有机物A 与浓硫酸混合加热,可以发生消去反应
D.1 mo1A 与足量的NaOH 溶液反应,最多可以消耗3mol NaOH
14、氢镍电池是一种应用广泛的可充电电池,它可以取代会产生镉污染的镉镍电池。氢镍电
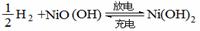 池的总反应为 。据此判断,下列叙述中正确的是
池的总反应为 。据此判断,下列叙述中正确的是
A.电池放电时,H2是正极
B.电池放电时,溶液中的阳离子移向正极
C.电池充电时,氢元素被氧化
D.电池放电时,电池负极周围溶液的pH不断增大
13、一定能在下列溶液中大量共存的离子组是
A.pH=0的溶液:Fe2+、Mg2+、NO3-、SO42-
B.由水电离出的c(H+)=1×10-13mol / L的溶液:HCO3-、K+、SO42-、Cl-
C.含大量Fe3+的溶液:NH4+、Na+、SCN-、Cl-
D.pH=14的溶液:Na+、K+、AlO2-、CO32-
12、 白磷在高压下隔绝空气加热后急速冷却,可得钢灰色固体--黑磷,其转化过程如下:
白磷在高压下隔绝空气加热后急速冷却,可得钢灰色固体--黑磷,其转化过程如下:
白磷 黑磷,黑磷比白磷稳定,结构与石墨相似。下列叙述正确的是
A.黑磷与白磷互为同分异构体 B.黑磷能导电
C.白磷转化为黑磷是氧化还原反应 D.白磷转化为黑磷是吸热反应
11、下列离子方程式正确的是
A.NaHCO3溶液中加入少量的石灰水 HCO3-+ Ca2+ + OH-=CaCO3↓+H2O
B.向氯化铁溶液中通入硫化氢气体 3Fe3+ + H2S = 2Fe2+ + FeS↓+2H+
C.氯化铝溶液中加入过量氨水 Al3+ + 4 OH- = AlO2-+ 2H2O
D.氨水中通入过量SO2 NH3·H2O + SO2 = HSO3- + NH4+
10、下列说法正确的是
A.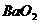 (过氧化钡)固体中的阴离子和阳离子之比为2∶1
(过氧化钡)固体中的阴离子和阳离子之比为2∶1
B.在SiO2晶体中,1个Si原子和2个O原子形成2个共价键
C.HCl的相对分子质量大于HF,所以HCl的沸点高于HF
D.由ⅠA族和ⅥA族元素可形成原子个数比为1∶1、电子总数为38的化合物
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com