
题目列表(包括答案和解析)
29.(14分)在100℃时,将0.100 mol的四氧化二氮气体充入1 L恒容抽空的密闭容器中,隔一定时间对该容器内的物质浓度进行分析得到下表数据:
|
时间(s) |
0 |
20 |
40 |
60 |
80 |
|
c(N2O4)/mol/L |
0.100 |
c1 |
0.050 |
c3 |
c4 |
|
c(NO2)/mol/L |
0.000 |
0.060 |
c2 |
0.120 |
0.120 |
(1)该反应的平衡常数表达式为 ;从表中数据分析:c1 c2;c3 c4(填“>”、“<”或“=”)。
(2)在下图中画出并标明此反应中N2O4和NO2的浓度随时间变化的曲线。
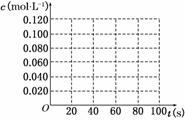
(3)在上述条件下,从反应开始至达到化学平衡时,四氧化二氮的平均反应速率为 mol/(L·s)。
(4)达平衡后下列条件的改变可使NO2气体浓度增大的是 。
A.增大容器的容积 B.再充入一定量的N2O4
C.分离出一定量的NO2 D.再充入一定量的He
(5)其他条件不变,若起始时充入NO2气体0.080 mol,则达到平衡时NO2气体的转化率为 。
28.(2分)燃烧a g乙醇(液态)生成CO2气体和液态H2O,放出热量为Q kJ,经测定a g乙醇与足量Na反应能生成H2 5.6 L(标准状况下),则表示乙醇燃烧热的热化学方程式为(△H的值不用a表示) 。
27.(6分)今有a.盐酸 b.硫酸 c.醋酸三种酸:
(1)在同体积、同pH的三种酸中,分别加入足量的碳酸钠粉末,在相同条件下产生CO2的体积由大到小的顺序是_________________;
(2)在同体积、同浓度的三种酸中,分别加入足量的碳酸钠粉末,在相同条件下产生CO2的体积由大到小的顺序是_________________;
(3)物质的量浓度均为0.1 mol·L-1的三种酸溶液的pH由大到小的顺序是___________。
26.(3分)现有下列物质 ①NaCl晶体 ②液态SO2 ③纯醋酸 ④硫酸钡 ⑤铜 ⑥酒精(C2H5OH)
⑦熔化的KCl ⑧NaOH溶液
请用以上物质回答下列问题。(填序号)
(1)属于强电解质且在上述状态下能导电的是 ; (2)属于弱电解质的是 ; (3)属于非电解质,但溶于水后的水溶液能导电的是 。
25.在0.1mol/L醋酸溶液中,要使醋酸的电离度和溶液的pH都减小,同时又使醋酸根离子浓度增大,可加入的试剂是( )
A.CH3COONa浓溶液 B.1mol/L氨水
C.1mol/L硫酸溶液 D.2mol/LCH3COOH溶液
|
24.下列事实不能用勒夏特列原理来解释的是( )
A. 往H2S水溶液中加碱有利于S2-增多
B. 在二氧化硫的催化氧化反应中,通入过量的空气以提高二氧化硫的转化率
C. 高压有利于合成NH3的反应
D. 500℃左右比室温更有利于合成NH3的反应
23. 向某密闭容器中充入1molCO和2molH2O(g),发生反应:CO+H2O (g) CO2 +H2。当反应达到平衡时,CO的体积分数为x。若维持容器的体积和温度不变,起始物质按下列四种配比充入该容器中,达到平衡时CO的体积分数小于x的是 ( )
向某密闭容器中充入1molCO和2molH2O(g),发生反应:CO+H2O (g) CO2 +H2。当反应达到平衡时,CO的体积分数为x。若维持容器的体积和温度不变,起始物质按下列四种配比充入该容器中,达到平衡时CO的体积分数小于x的是 ( )
A.0.5molCO+2molH2O(g)+1molCO2+1molH2
B.1molCO+1molH2O(g)+1molCO2+1molH2 .
C.0.5molCO+1.5molH2O(g)+0.4molCO2+0.4molH2
D.0.5molCO+1.5molH2O(g)+0.5molCO2+0.5molH2
22.已知热化学方程式:2SO2(g)+O2(g) 2SO3(g)△H=-QkJ·mol-1(Q>0)。下列说法正确的是 ( )
2SO3(g)△H=-QkJ·mol-1(Q>0)。下列说法正确的是 ( )
A.相同条件下,2molSO2和1molO2所具有的能量小于2molSO3所具有的能量
B.将2molSO2(g)和1molO2(g)置于一密闭容器中充分反应后,放出热量为QkJ
C.增大压强或升高温度,该平衡都向逆反应方向移动
D.如将一定量SO2(g)和O2(g)置于某密闭容器中充分反应后放热QkJ,则此过程中有2molSO2(g)被氧化
21.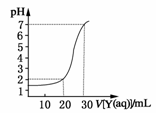 如图为对10 mL一定物质的量浓度的盐酸X用一定物质的量浓度的NaOH溶液Y滴定的图像,依据图像推出X和Y的物质的量浓度是下表内各组中的 (
)
如图为对10 mL一定物质的量浓度的盐酸X用一定物质的量浓度的NaOH溶液Y滴定的图像,依据图像推出X和Y的物质的量浓度是下表内各组中的 (
)
20.从下列叙述中,能肯定判断某化学平衡发生移动的是( )
A.混合物中各组分的浓度改变 B.反应物的转化率改变
C.正、逆反应速率改变 D.混合体系中气体密度发生改变
|
|
A |
B |
C |
D |
|
X/(mol·L-1) |
0.12 |
0.04 |
0.03 |
0.09 |
|
Y/(mol·L-1) |
0.04 |
0.12 |
0.09 |
0.03 |
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com